今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42-,现取三份100mL溶液进行如下实验:
(1)第一份加入AgNO3溶液有沉淀产生(2)第二份加足量NaOH溶液加热后,收集到气体0.04mol
(3)第三份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g。根据上述实验,以下推测正确的是( )
A K+一定存在 B 100mL溶液中含0.01mol CO32-
C Cl-可能存在 D Ba2+一定不存在,Mg2+可能存在
1L 0.1mol/L的AgNO3溶液在以Ag作阳极,Fe作阴极的电解槽中电解,当阴极上增重2.16g时,下列判断正确的是
| A.电解质AgNO3溶液的浓度变为0.08mol/L |
| B.阳极上产生112mLO2(标况) |
| C.转移1.204×1022个电子 |
| D.反应中有0.01mol的Ag被氧化 |
以CuSO4溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Au等杂质)的电解精炼,下列说法正确的是
| A.利用阳极泥可回收Ag、Au等金属 |
| B.阳极减少的质量一定等于阴极增加的质量 |
| C.精炼过程中,CuSO4溶液的浓度不发生改变 |
| D.因部分电能转化为热能,精炼时通过的电量与阴极铜的析出量无确定关系 |
有关下图的说法正确的是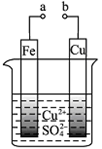
| A.构成原电池时溶液中SO42-移向Cu极 |
| B.构成原电池时Cu极反应为:Cu﹣2e-===Cu2+ |
| C.构成电解池时Fe极质量既可增也可减 |
| D.a和b分别接直流电源正、负极,Fe极会产生气体 |
下列叙述中,不符合生产实际的是
| A.电解法精炼铜,用纯铜做阴极 |
| B.电解熔融的氧化铝制取金属铝,用铁做阳极 |
| C.电解饱和食盐水,用碳网做阴极 |
| D.在镀件上镀锌,用锌做阳极 |
利用电解原理,在铁皮表面镀一层锌的有关叙述正确的是
| A.铁为负极,锌为正极 | B.铁为阳极,锌为阴极 |
| C.用可溶性铁盐作电解液 | D.锌元素既被氧化又被还原 |