有关溶液中所含离子的检验,下列判断中正确的是( )
| A.加入AgNO3溶液生成的白色沉淀不溶于稀盐酸,则原溶液中一定有Cl-存在 |
| B.加入氨水时生成白色沉淀,当氨水过量时白色沉淀消失,则原溶液中一定有Al3+存在 |
| C.加入NaOH溶液并加热,有能使湿润的红色石蕊试纸变蓝的气体生成,则原溶液中一定有NH4+存在 |
| D.加入盐酸有能使澄清石灰水变浑浊的气体生成,则原溶液中一定有大量CO32-存在 |
在一种酸性溶液中存在NO3-、I-、Cl-、Fe3+中的一种或几种,向该溶液中加入溴水,溴单质被还原,由此可推断该溶液中
| A.一定含有I-,不能确定是否有Cl— | B.一定含有NO3- |
| C.不含有Fe3+,一定含有Cl— | D.一定含有I一、NO3-和Cl |
下列说法正确的是
A.H、D、T属于同位素,H2、D2、T2属于同素异形体
B.氯水、氨水、王水是混合物,水银、水玻璃是纯净物
C.HCl、NH3、BaSO4是电解质,CO2、Cl2、CH3CH2OH是非电解质
D.水能、风能、生物质能是可再生能源,煤、石油、天然气是不可再生能源
下列有关叙述中错误的是
| A.油脂都不能使溴水褪色 |
| B.蔗糖和淀粉的水解产物不同 |
| C.用灼烧的办法可以鉴别蚕丝和人造丝 |
| D.用饱和碳酸氢钠溶液可以除去乙酸乙酯中混有少量的乙酸 |
化学与环境、材料和科技等密切相关。下列说法中错误的是
| A.向煤中加入适量CaO可大大减少燃烧产物中SO2的量 |
| B.光导纤维在信息产业中有广泛应用,制造光导纤维的主要材料是单质硅 |
| C.即将到来的新能源时代,核能、太阳能和氢能等很可能成为主要能源 |
| D.“嫦娥二号”于2010年10月1日成功“奔月”,在制造过程中使用了大量的复合材料 |
下列化学用语的书写,正确的是()
A.氮气的电子式: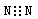 |
B.硫原子的结构示意图: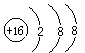 |
C.溴化钠的电子式: 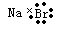 |
D.水分子的结构式: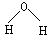 |