乙醇分子结构中各化学键如图所示。关于乙醇在各种反应中断裂键的说法不正确的是 ( ) 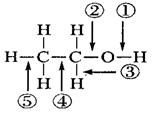
| A.和金属钠反应时键①断裂 |
| B.和浓H2SO4共热到170 ℃时断键②和⑤ |
| C.在银催化条件下与O2反应时断键①和③ |
| D.和浓H2SO4共热到140 ℃时断键②,其他键不变化 |
强酸溶液A与强碱溶液B,在常温下其pH之和为15,当它们按一定体积比混合时,溶液的pH恰好为7,则A与B的体积比为
| A.1∶1 | B.2∶1 | C.1∶10 | D.10∶1 |
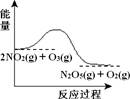
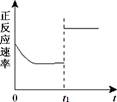
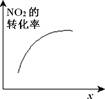
臭氧是理想的烟气脱硝试剂,其脱硝反应为2NO2(g) + O3(g) N2O5(g) + O2(g),若反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是
N2O5(g) + O2(g),若反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是
| A |
B |
C |
D |
 |
 |
 |
 |
| 升高温度, 平衡常数减小 |
0~3 s内,反应速率为 v(NO2) =" 0.2" mol·L-1 |
t1时仅加入催化剂,平衡正向移动 |
达平衡时,仅改变x,则x为c(O2) |
下列各组离子中,在给定条件下能大量共存的是
| A.在pH = 1的溶液中:NH4+、K+、ClO-、Cl- |
| B.有SiO32-存在的溶液中:Na+、Mg2+、Al3+、Cl- |
| C.有NO3-存在的强酸性溶液中:NH4+、Ba2+、Fe2+ 、Br- |
| D.在c(H+) = 1.0×10-13 mol·L-1的溶液中:Na+、S2-、AlO2-、SO32- |
下列说法正确的是
| A.草酸溶液与酸性KMnO4溶液混合后,由于生成物对反应有催化作用,会使反应速率加快 |
| B.KI、H2SO4、淀粉溶液混合后,高温时出现蓝色时间反而较短,可能是因为高温时此反应较慢 |
| C.恒温下,将盛有NO2和N2O4的平衡体系加压,体系颜色最终变浅 |
| D.在K2Cr2O7溶液中滴加浓硫酸,溶液颜色由橙变黄(Cr2O72-为橙色) |
25℃时,水的电离达到平衡:H2O H+ + OH-,下列叙述正确的是
H+ + OH-,下列叙述正确的是
| A.向水中加入稀氨水,平衡逆向移动,c(OH-)降低 |
| B.向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变 |
| C.向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低 |
| D.将水加热,Kw增大,pH不变 |