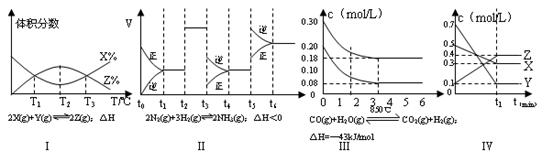
| A.由图象Ⅰ知,该反应在T1、T3处达到平衡,且该反应的△H<0 |
| B.由图象Ⅱ知,该反应在t5阶段NH3体积分数最大 |
| C.图象Ⅲ是在10L容器中850℃时反应,由图知,到4min时,反应放出51.6kJ的热量 |
| D.由图象Ⅳ知,相同条件下起始时投入0.3mol/LX、0.1mol/LY和0.4mol/LZ反应,达到平衡后,Z的浓度为0.4mol/L |
下列溶液显酸性的是()
| A.NaCl溶液 | B.Na2CO3溶液 | C.AlCl3溶液 | D.KNO3溶液 |
把0.02 mol/L CH3COOH溶液和0.01 mol/L NaOH溶液以等体积混和后溶液显酸性,则混合液中微粒浓度关系正确的为()
| A.c(CH3COO-)<c(Na+) |
| B.c(CH3COOH)+c(CH3COO-)="0.02" mol/L |
| C.c(CH3COOH)>c(CH3COO-) |
| D.c(OH-)+c(CH3COO-)=c(H+)+c(Na+) |
将0.1 L含有0.02mol CuSO4和0.01molNaCl的水溶液用惰性电极电解。电解一段时间后,一个电极上得到0.01 mol Cu,另一电极析出的气体()
| A.只有Cl2 | B.只有O2 | C.既有Cl2又有O2 | D.只有H2 |
下列说法正确的是()
| A.在一定温度下AgCl水溶液中,Ag+和Cl-浓度的乘积是一个常数 |
| B.AgCl的 Ksp = 1.8×10-10 mol2·L-2,在任何含AgCl固体的溶液中,c(Ag+) = c(Cl-)且Ag+与Cl-浓度的乘积等于1.8×10-10 mol2·L-2 |
| C.温度一定时当溶液中Ag+和Cl-浓度的乘积等于Ksp值时,此溶液为AgCl的饱和溶液 |
| D.向饱和AgCl水溶液中加入盐酸,Ksp值变大 |
高铁电池是一种新型可充电电池,电解质溶液为KOH溶液,放电时的总反应式为3Zn+2K2FeO4+8H2O===3Zn(OH)2+2Fe(OH)3+4KOH。下列叙述正确的是()
| A.放电时,负极反应式为3Zn-6e-+6OH-===3Zn(OH)2 |
| B.放电时,正极区溶液的pH减小 |
| C.充电时,每转移3 mol电子,阳极有1 mol Fe(OH)3被还原 |
| D.充电时,电池的锌电极接电源的正极 |