已知298K时, N2(g)+3H2(g)="2" NH3(g);△H=-92.4kJ/mol, 在相同条件下,向密闭容器中加入1molN2和3molH2,达到平衡时放出的热量为Q1,向另一容积相同的密闭容器中通入0.95molN2、2.85molH2和0.1molNH3,达到平衡时放出的热量为Q2,则下列关系式正确的是
| A.Q1 = Q2 =" 92.4kJ" |
| B.Q2 < Q1 = 92.4kJ |
| C.Q2< Q1<92.4kJ |
| D.Q2 = Q1< 92.4kJ |
下列溶液中有关物质的量浓度关系正确的是
| A.pH = 2的醋酸溶液与pH = 12的NaOH溶液等体积混合: c (Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| B.等物质的量浓度的H2S和NaHS混合溶液中: c(Na+)+ c(H+) = c(S2-)+ c(HS-)+ c(OH-) |
| C.NaHCO3溶液中:c(OH-)-c(H+)=c(H2CO3)—c(CO32-) |
| D.0.1 mol·L-1Na2CO3溶液与0.1 mol·L-1NaHCO3溶液等体积混合: |
c(CO32-)+2c(OH-)=c(HCO3-)+3c(H2CO3)+2c(H+)
根据表中提供的数据,判断下列说法正确的是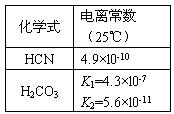 AB电离理论
AB电离理论
| A.等浓度的NaCN、NaHCO3、Na2CO3溶液中, pH(Na2CO3)>pH(NaCN)>pH(NaHCO3) |
| B.a mol/L HCN溶液与b mol/L NaOH溶液等体积混合后, 所得溶液中c(Na+)=c(CN-),则a一定大于b |
| C.等浓度的NaCN、NaHCO3混合溶液中, c(Na+)+ c(H+) =c(CN-) + c(HCO3-) + c(OH-) |
| D.NaCN溶液中通入少量CO2,发生的反应可表示为 |
2NaCN + H2O + CO2 →2HCN + Na2CO3
化学在生产和日常生活中有着重要的应用。下列说法不正确的是
| A.铵态氮肥不能与草木灰混合施用 |
| B.高温能杀死H1N1流感病毒的原因是蛋白质受热变性 |
| C.镁合金的硬度和强度均高于纯镁,工业上采用电解熔融状态的MgCl2制得金属镁 |
| D.常温下浓硝酸与铝不反应,可用铝制容器存放浓硝酸 |
下列有关实验中叙述不正确的是
①用硝酸钡溶液鉴别硫酸根离子与亚硫根离子②用溴水检验汽油中是否含有不饱和脂肪烃③用乙醇从碘水中萃取碘④用盐析方法分离提纯蛋白质⑤用加热方法提纯含有少量碳酸氢钠的碳酸钠固体⑥用氨水清洗试管壁附着的银镜 ⑦在蔗糖中加入几滴水搅拌均匀,再加入浓硫酸,迅速搅拌,蔗糖逐渐变黑,体积膨胀,形成疏松多孔的物质,只体现了浓硫酸的脱水性
| A.②④⑤⑦ | B.①③⑥ | C.①②④⑤ | D.②③④⑤⑥ |
下列离子方程式正确的是
| A.亚磷酸是一种二元酸,在其中加入过量的烧碱溶液:H3PO3+3OH-=PO33-+3H2O |
| B.氯化银可被NaCN溶液所溶解:AgCl+2CN-=[Ag(CN)2]-+C1- |
| C.偏铝酸钠溶液中通入过量的二氧化碳气体: 2AlO2-+CO2+2H2O=2Al(OH)3↓+CO32- |
| D.三氯化铁溶液中通入硫化氢气体:2Fe3++H2S=2Fe2++S↓+2H+ |