进行如下实验,在A锥形瓶中放入10 g块状CaCO3,在B锥形瓶中放入5 g粉末状的CaCO3,分别加入50 mL 2 mol·L-1盐酸。图中能正确表示实验结果的是( )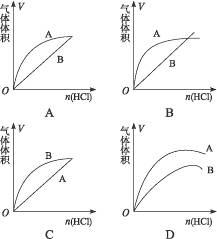
下列示意图中,白球代表氢原子,黑球代表氦原子,方框代表容器,容器中间有一个可以上下滑动的隔板(其质量忽略不计)。其中不能表示等质量的氢气与氦气的是( )
下列各项中的计算结果正确的是( )
| A.标准状况下,2.24 L N2和NH3的混合气体:原子间共有3×6.02×1022个共用电子对 |
| B.常温下,Fe(OH)3悬浊液中由Fe(OH)3电离出的c(OH-)≈10-10 mol·L-1:溶液的pH约为4 |
| C.0℃时,22.4 L密闭容器中充入88 g CO2气体:容器中的压强约为1个大气压 |
| D.标准状况下,1体积水中溶解了40体积NH3:该溶液的质量分数为97.4% |
传统“陈醋”生产过程中有一步称为“冬捞夏晒”,是指冬天捞出醋中的冰,夏日曝晒蒸发醋中的水分,以提高醋的品质。假设用含醋酸质量分数为3%的半成醋,生产500 g 0.945 mol/L的优级醋(密度为1.05 g/mL),生产过程中醋酸没有损失,捞出的冰和蒸发的水的总质量为( )
| A.100 g | B.200 g | C.300 g | D.400 g |
在t℃时将a g NH3完全溶于水,得到V mL溶液,假如该溶液的密度为d g/cm3,质量分数为ω,其中含NH4+的物质的量为b mol。下列叙述正确的是( )
| A.溶质的质量分数为ω=×100% |
| B.氨水的物质的量浓度为1000a/(35V)mol·L-1 |
| C.溶液中c(OH-)=1000b/V mol·L-1+c(H+) |
| D.上述溶液中再加入V mL水后,所得溶液的质量分数大于0.5ω |
300mL Al2(SO4)3溶液中,溶有Al3+ 1.62g,在该溶液中加入0.1mol/L Ba(OH)2溶液300mL,反应后溶液中SO42-的物质的量浓度为( )
| A.0.4mol/L | B.0.3mol/L | C.0.2mol/L | D.0.1mol/L |