一定温度下,在恒容密闭容器中发生如下反应:2A(g)+B(g) 3C(g),若反应开始时充入2 mol A和2 mol B,达平衡后A的体积分数为a%,其他条件不变时,若按下列四种配比作为起始物质,平衡后A的体积分数大于a的是( )
3C(g),若反应开始时充入2 mol A和2 mol B,达平衡后A的体积分数为a%,其他条件不变时,若按下列四种配比作为起始物质,平衡后A的体积分数大于a的是( )
| A.2 mol C |
| B.2 mol A,1 mol B和1 mol He(不参加反应) |
| C.1 mol B和1 mol C |
| D.2 mol A,3 mol B和3 mol C |
配制一定物质的量浓度的NaOH溶液,下列操作正确的是
| A.将NaOH固体直接放在托盘天平的托盘上称量 |
| B.将NaOH固体加水溶解,待所得溶液冷却到室温后,再转移至容量瓶中 |
| C.定容时如果加水超过了刻度线,用胶头滴管直接吸出多余部分 |
| D.定容摇匀后发现溶液体积低于刻度线,再补加少量蒸馏水至刻度线 |
将Na2O2投入FeCl3溶液中,对观察到的现象描述准确的是
| A.生成白色沉淀 | B.生成红褐色沉淀 |
| C.有气泡产生 | D.生成红褐色沉淀、有气泡产生 |
在无色的强酸性溶液中能大量共存的是
| A.Mg2+、Na+、Cl-、SO42- | B.K+、 Na+、 Cl-、 Cu2+ |
| C.K+ 、Na+、NO3-、CO32- | D.Na+、Ba2+、OH-、SO42- |
如图所示,A处通入氯气,关闭旋塞B时,C处红色布条无明显的变化,打开旋塞B时,C处红色布条逐渐褪色。由此作出的判断正确的是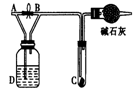
| A.D中不可能是浓硫酸 | B.D中可以是水 |
| C.通入的氯气中含有水蒸气 | D.D中可以是饱和食盐水 |
下列离子方程式书写正确的是
| A.盐酸与碳酸钡反应:CO32-+2H+=CO2↑+H2O |
| B.往硫酸铜溶液中滴加氢氧化钡溶液:Ba2++2OH-+Cu2++SO42-= BaSO4↓+Cu(OH)2↓ |
| C.稀硫酸溶液与氨水反应:H++OH-=H2O |
| D.铁与稀盐酸反应:2Fe+6H+=2Fe3++3H2↑ |