在一定温度下,把2体积N2和6体积H2通入一个带活塞的体积可变的容器中,活塞的一端与大气相通(如图2-36)。
容器中发生以下反应:N2+3H2 2NH3(正反应放热),若反应达到平衡后,测得混合气体为7体积。据此完成下列问题:
2NH3(正反应放热),若反应达到平衡后,测得混合气体为7体积。据此完成下列问题:
图2-36
(1)保持上述温度不变,设a、b、c分别代表初始加入的N2、H2和NH3的体积,如果反应达到平衡后混合气体中各物质的体积分数仍与上述平衡时完全相同。那么:
①若a=1,c=2,则b=_________,在此情况下,反应起始时将向(填“正”或“逆”)反应方向进行。②若需规定起始时,反应向逆方向进行,则c的范围是_________。
(2)在上述装置中,若需控制平衡后混合气体为6.5体积,则可采取的措施是____________,原因是________________________。
(6分)将100 mL 5 mol·L-1 NaOH(aq)稀释到500 mL,稀释后溶液中NaOH的物质的量浓度为______________;将氯气通入此溶液充分反应,可制得漂白液,其中含有效成分的物质的量最多为_________________。
(6分)将一定量的Mg、Al投入100mL一定的物质的量浓度的盐酸中,合金全部溶解。向所得溶液中滴加5mol/L的NaOH至过量,生成的沉淀的质量与加入NaOH的体积的关系如图所示。
①A点时,n Mg(OH)2= mol;nAl(OH)3= mol。
②原HCl的物质的量浓度c= mol/L
(本题共14分)合金的性能往往优于组成金属,因而用途非常广泛。钠钾合金可在核反应堆中用作导热剂。5.05g钠钾合金溶于200mL水生成0.075mol氢气。
54.计算溶液中氢氧根离子的物质的量浓度(忽略溶液体积变化)。
55.计算并确定该钠-钾合金的化学式。
镁铝合金广泛用于火箭、导弹和飞机制造业等。取不同质量的镁铝合金样品分别和30ml相同浓度的盐酸反应,所取合金质量与产生气体体积(标况下)如下表所示:
| 实验序号 |
A |
B |
C |
| 合金质量/mg |
510 |
765 |
918 |
| 气体体积/mL |
560 |
672 |
672 |
56.计算镁铝合金中镁铝的质量之比。
铜锡合金,又称青铜,是人类使用最早的合金。不同的铜锡比例可以产生不同的效用,若含锡量为1/4—1/7(质量比)的青铜被称作重青铜,受敲击时能发出洪亮的声音。
57.现有一铜锡合金样品,可通过至少增加ag铜或至少减少bg锡恰好使其成为钟青铜,且最终得到的钟青铜质量正好相差一半。求原铜锡合金样品中铜锡的物质的量之比。
把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后有白色沉淀生成,在所得的悬浊液中逐滴加入1 mol·L-1HCl溶液,加入HCl溶液的体积V与生成沉淀的质量m的关系如图所示。
试回答:
(1)从0开始到A点沉淀物的化学式为;B点沉淀物的化学式为。
(2)原混合物中的MgCl2的物质的量为,AlCl3的物质的量为,NaOH的物质的量为。
(3)HCl溶液在C点的体积数是mL。
把一小块镁铝合金溶于100mL盐酸中,然后向其中滴入1 mol·L-1NaOH溶液,生成沉淀的质量和加入NaOH溶液的体积如下图所示。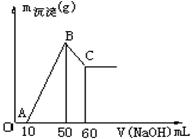
①写出OA段的离子反应方程式
②写出BC段的化学方程式
③合金中镁的质量g。
④盐酸的物质的量浓度mol·L-1。