在一密闭容器中进行以下可逆反应:
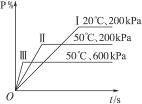
M(g)+N(g) P(g)+2L
P(g)+2L
在不同的条件下P的百分含量P%的变化情况如图,则该反应( )
| A.正反应放热,L是固体 | B.正反应放热,L是气体 |
| C.正反应吸热,L是气体 | D.正反应放热,L是固体或气体 |
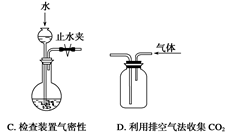
下列装置或操作能达到实验目的的是() 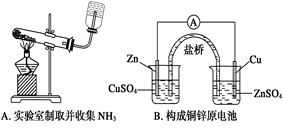
短周期元素M、W、X、Y、Z的原子序数依次增大,M元素的一种核素没有中子,且
M、W、X、Y+、Z的最外层电子数与其电子层数的比值依次为1、2、3、4、2(不考虑零族元素)。下列关于这些元素的叙述正确的是()
| A.X分别和其它四种元素均可形成至少2种化合物 |
| B.M分别和W、X、Y、Z形成化合物,均显相同化合价 |
| C.M、X、Z三种元素组成的化合物含有离子键 |
| D.M、X、Y组成化合物和Y、Z组成化合物,其等物质的量浓度的水溶液中由水电离出的氢离子浓度相同 |
下列关于氧化物的各项叙述正确的是()
①酸性氧化物不一定是非金属氧化物②非金属氧化物肯定是酸性氧化物
③碱性氧化物肯定是金属氧化物④金属氧化物肯定是碱性氧化物
⑤酸性氧化物均可与水反应生成相应的酸
⑥与水反应生成酸的氧化物不一定是酸酐,与水反应生成碱的氧化物不一定是碱性氧化物
⑦不能跟酸反应的氧化物一定能跟碱反应
| A.①③⑥ | B.①②⑤⑦ | C.③④⑤ | D.①②⑤ |
下列离子方程式不正确的是()
| A.用碳酸钠溶液吸收少量二氧化硫:2CO32-+SO2+H2O=2HCO3-+SO32- |
| B.向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液使SO42-沉淀完全: 2Ba2++NH4++Al3++2SO42- +4OH-= Al(OH)3↓ +2 BaSO4↓+ NH3·H2O |
| C.Cl2与FeI2溶液反应,当n(Cl2):n(FeI2)=1:1时,2Fe2+ + 2I- +2Cl2 =" 2" Fe3+ + 2I2 + 4Cl- |
| D.将1 mol/L NaAlO2溶液和1.5 mol/L HCl溶液等体积互相均匀混合:6AlO2-+9H++3H2O=5Al(OH)3↓+Al3+ |
下列实验方案不能达到预期目的的是()
| 选项 |
实验方案 |
预期目的 |
| A |
将含有HCl的CO2气体通过饱和NaHCO3溶液 |
除去CO2中的HCl |
| B |
向X溶液中滴加盐酸酸化的BaCl2溶液 |
检验X溶液中是否含有SO42- |
| C |
向醋酸钠溶液中滴入酚酞试液,加热后若红色加深 |
证明盐类的水解是吸热的 |
| D |
向含有少量苯酚的苯中加入NaOH溶液,振荡、静置、分液 |
除去苯中的苯酚 |