在一真空密闭容器中盛有n mol PCl5,在200 ℃时发生如下反应:PCl5(g)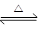 PCl3(g)+Cl2(g),反应达到平衡时,PCl3所占体积分数为M%。若在同一温度,同一容器中,最初投入的是2n mol PCl5反应达到平衡时,PCl3的体积分数为N%。则M和N的关系是( )
PCl3(g)+Cl2(g),反应达到平衡时,PCl3所占体积分数为M%。若在同一温度,同一容器中,最初投入的是2n mol PCl5反应达到平衡时,PCl3的体积分数为N%。则M和N的关系是( )
| A.M>N | B.M<N | C.M="N" | D.无法比较 |
下列各组物质的分类正确的是
①混合物:水玻璃、水银、水煤气②电解质:明矾、冰醋酸 ③酸性氧化物:CO2、CO、SO3
④同位素:1H、2H2、3H ⑤同素异形体:C60、金刚石、石墨 ⑥干冰、液氯都是非电解质
| A.①②③④⑤⑥ | B.仅②⑤ | C.仅②④⑤⑥ | D.仅②⑤⑥ |
下列有关实验操作的说法正确的是
| A.用10mL量筒量取8.10mL稀盐酸;用托盘天平称取25.0g氯化钠 |
| B.可用25mL碱式滴定管量取20.00mL KMnO4溶液 |
| C.用pH试纸测得某溶液的pH为2 |
| D.用pH试纸测定溶液的pH时,需先用蒸馏水润湿试纸 |
读下列药品标签,有关分析不正确的是
| 选项 |
A |
B |
C |
D |
| 物品 标签 |
饱和氯水 1.01×105 Pa 20 ℃ |
药品:××× |
碳酸氢钠 NaHCO3 俗名 小苏打 (84 g/mol) |
浓硫酸 H2SO4 密度 1.84 g/mL 浓度98.0% |
| 分析 |
该试剂应装在玻璃塞的棕色细口瓶中 |
该药品不能与皮肤直接接触 |
该物质受热易分解 |
该物质浓度为9.6 mol/L |
下列说法正确的是(NA表示阿伏加德罗常数的值)
| A.在常温常压下,11.2 L N2含有的原子数为NA |
| B.32 g O2在标准状况下所占体积约为22.4 L |
| C.标准状况下,18 g H2O所占的体积约为22.4 L |
| D.在同温同压下,相同体积的任何气体单质所含的原子数相同 |
在标准状况下①6.72 L CH4②3.01×1023个HCl分子 ③13.6 g H2S ④0.2 mol NH3,下列对这四种气体的关系从大到小表达正确的是
a.体积②>③>①>④
b.密度②>③>④>①
c.质量②>③>①>④
d.氢原子个数①>③>④>②
| A.仅abc | B.仅bcd | C.abcd | D.仅acd |