下列事实不能用平衡移动原理加以解释的是( )
| A.升高温度促进SO2转化为SO3 |
B.在反应2SO2+O2 2SO3中,增加O2可提高SO2的转化率 2SO3中,增加O2可提高SO2的转化率 |
| C.可用浓NH3·H2O和烧碱固体快速制NH3 |
| D.加压有利于SO2和O2反应生成SO3 |
下列说法中正确的是( )
| A.分子中键能越大,键长越长,则分子越稳定 |
| B.元素周期表中的第ⅠA族(除H外)和第ⅦA族元素的原子间不能形成共价键 |
| C.水分子可表示为HO—H,分子中键角为180° |
| D.H—O键键能为463 kJ·mol-1,即18gH2O分解成H2和O2时,消耗能量为926kJ |
下列有关电负性的说法中正确的是( )
| A.主族元素的电负性越大,元素原子的第一电离能一定越大 |
| B.在元素周期表中,元素电负性从左到右越来越大 |
| C.金属元素电负性一定小于非金属元素电负性 |
| D.在形成化合物时,电负性越小的元素越容易显示正价 |
图中是部分短周期元素化合价与原子序数的关系图,下列说法正确的是( )
| A.原子半径:Z>Y>X |
| B.气态氢化物的稳定性:R﹤W |
| C.WX3和水反应形成的化合物是离子化合物 |
| D.Y和Z两者最高价氧化物对应的水化物能相互反应 |
下列叙述错误的是()
(1)若R的含氧酸的酸性大于Q的含氧酸的酸性,则非金属性R大于Q
(2)阴、阳离子通过静电吸引形成的化学键叫离子键
(3)H2O、H2S、H2Se的相对分子质量增大,所以熔沸点依次升高
(4)液态氟化氢中存在氢键,所以其分子比氯化氢更稳定
(5)都是由非金属元素形成的化合物只能是共价化合物
| A.全部 | B.(1)(2)(3)(4) |
| C.(1)(2)(3)(5) | D.(2)(3)(4) |
下列化学用语表示正确的是( )
A.甲基的电子式: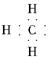 |
B.氮原子的轨道表示式: |
| C.氯离子的最外层电子排布:3s23p6 |
D.硫离子的结构示意图: |