X、Y、Z为三种气体,把a mol X和b mol Y充入一密闭容器中,发生如下反应:X+2Y 2Z。达到平衡时,若它们的物质的量满足n(X)+n(Y)=n(Z),则Y的转化率为( )
2Z。达到平衡时,若它们的物质的量满足n(X)+n(Y)=n(Z),则Y的转化率为( )
A. ×100% ×100% |
B. ×100% ×100% |
C.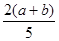 ×100% ×100% |
D.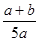 ×100% ×100% |
一定温度下,在一容积固定的密闭容器中,建立了下列平衡:2NO2 N2O4,恒温下,再向容器通入一定量N2O4,重新建立平衡后,容器中N2O4的体积分数
N2O4,恒温下,再向容器通入一定量N2O4,重新建立平衡后,容器中N2O4的体积分数
| A.减少 | B.增大 | C.不变 | D.无法判断变化情况 |
在相同条件下(T=500K),有相同体积的甲、乙两密闭容器。甲容器中充入1 g SO2和1 g O2;乙容器中充入2 g SO2和2 g O2。下列叙述错误的是
| A.化学反应速率:乙>甲 |
| B.平衡后SO3的浓度:乙>甲 |
| C.SO2的转化率:乙>甲 |
| D.平衡后SO2的体积分数:乙>甲 |
人类将在二十一世纪大量使用氢气作燃料,其中最理想的获取氢气的途径是
| A.以焦炭和水制取水煤气后分离出氢气 |
| B.用铁、锌等活泼金属与稀硫酸制取氢气 |
| C.由火力发电厂提供电力电解水产生氢气 |
| D.利用高效催化剂和太阳能使海水分解产生氢气 |
某溶液中含有Ba2+,Cu2+,Ag+,现用NaOH溶液、盐酸和Na2SO4溶液将这三种离子逐一沉淀分离,其流程如右图所示。下列说法正确的是()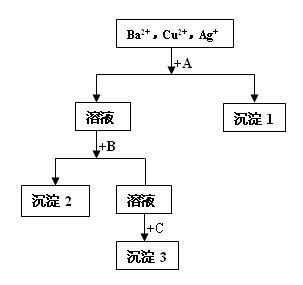
| A.试剂A为Na2SO4溶液 |
| B.沉淀3的化学式可能是BaSO4 |
| C.生成沉淀1的离子方程式为:Cu2+ + 2OH- = Cu(OH)2↓ |
| D.生成沉淀2的离子方程式为:Ag++ Cl- = AgCl↓ |
在相同条件下,A容器中的CH4和 B容器中的NH3所含原子总数相等,则两个容器的体积比为
B容器中的NH3所含原子总数相等,则两个容器的体积比为 ()
()
| A.1 :2 | B.4 :5 | C.5 :4 | D.2 :1 |