恒温、恒压下,a mol A和b mol B在一个容积可变的容器中发生如下反应:
A(g)+2B(g) 2C(g)
2C(g)
一段时间后达到平衡,生成n mol C。则下列说法正确的是( )
A.物质A、B的转化率之比为a∶b
B.起始时刻和达平衡后容器中的压强比为(a+b)∶(a+b-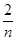 )
)
C.若起始时放入2a mol A和2b mol B,则达平衡时生成2n mol C
D.当v正(A)=2v逆(B)时,可确定反应达平衡
下列有关气体摩尔体积的描述中正确的是
| A.单位物质的量的气体所占的体积叫做气体摩尔体积 |
| B.通常状况下的气体摩尔体积约为22.4L |
| C.标准状况下的气体摩尔体积约为22.4L |
| D.相同物质的量的气体摩尔体积也相同 |
有一种气体的质量是14.2g,体积是4.48升(标况),该气体的摩尔质量是
| A.28.4 | B.28.4g·mol-1 | C.71 | D.71g·mol-1 |
能够用来鉴别BaCl2、 NaCl、 Na2CO3三种物质的试剂是
| A.AgNO3溶液 | B.稀硫酸 | C.稀盐酸 | D.稀硝酸 |
实验室中需要配制1mol/L的NaCl溶液970mL,配制时应选用的容量瓶的规格是
| A.950mL 容量瓶 | B.500mL容量瓶 |
| C.1000mL 容量瓶 | D.任意规格的容量瓶 |
下列实验操作中:①过滤②蒸发③溶解④取液体试剂⑤取固体试剂,一定要用玻璃棒的是
| A.①②③ | B.④⑤ | C.①④ | D.①③⑤ |