可逆反应N2+3H2 2NH3的正、逆反应速率可用各反应物或生成物浓度的变化来表示。下列各关系中能说明反应已达到平衡状态的是( )
2NH3的正、逆反应速率可用各反应物或生成物浓度的变化来表示。下列各关系中能说明反应已达到平衡状态的是( )
| A.3v正(N2)=v正(H2) |
| B.v正(N2)=v逆(NH3) |
| C.2v正(H2)=3v逆(NH3) |
| D.v正(N2)=3v逆(H2) |
有三种不同取代基-X,-Y,-Z,当它们同时取代苯分子中的3个氢原子,取代产物有 ( )
| A.4种 | B.6种 | C.10种 | D.14种 |
我国支持“人文奥运”的一个重要体现是:坚决反对运动员服用兴奋剂。兴奋剂的结构简式如图所示,有关该物质的说法正确的是( )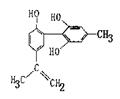
| A.遇FeCl3溶液显紫色,因为该物质与苯酚属于同系物 |
| B.滴入KMnO4(H+)溶液,观察紫色褪去,能证明结构中存在碳碳双键 |
| C.1mol该物质分别与浓溴水和H2反应时最多消耗Br2和H2分别为4mol、7mol |
| D.该物质能能与NaHCO3溶液发生反应 |
由2—氯丙烷为主要原料制1,2—丙二醇CH3CH(OH)CH2OH时,经过的反应为 ()
| A.加成—消去—取代 | B.消去—加成—取代 |
| C.取代—消去—加成 | D.取代—加成—消去 |
分子中含有4个碳原子的饱和一元脂肪醇,氧化后能生成醛的有()
| A.2种 | B.3种 | C.4种 | D.5种 |
下列实验中,能证明苯酚的酸性极弱的是()
| A.跟氢氧化钠溶液反应生成苯酚钠 |
| B.跟FeCl3溶液作用显紫色 |
| C.二氧化碳通入苯酸钠溶液能产生苯酚 |
| D.常温下苯酚在水中溶解度不大 |