在已达平衡的可逆反应2SO2+O2 2SO3体系中,加入一定量的18O2,足够长时间后,在_______________物质中存在18O原子。
2SO3体系中,加入一定量的18O2,足够长时间后,在_______________物质中存在18O原子。
由下图分析,有关叙述正确的是( )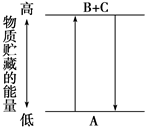
| A.A―→B+C和B+C―→A两个反应吸收或放出的能量不等 |
| B.A―→B+C是放热反应 |
| C.A具有的能量高于B和C具有的能量总和 |
| D.A―→B+C是吸热反应,则B+C―→A必然是放热反应 |
已知下列热化学方程式:
Zn(s)+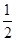 O2(g)==="ZnO(s)" ΔH1=-351.1 kJ/mol Hg(l)+
O2(g)==="ZnO(s)" ΔH1=-351.1 kJ/mol Hg(l)+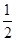 O2(g)==="HgO(s)" ΔH2=-90.7 kJ/mol
O2(g)==="HgO(s)" ΔH2=-90.7 kJ/mol
由此可知Zn(s)+HgO(s)===ZnO(s)+Hg(l)ΔH3,其中ΔH3的值是()
| A.-441.8 kJ/mol | B.-254.6 kJ/mol | C.-438.9 kJ/mol | D.-260.4 kJ/mol |
下列热化学方程式书写正确的是(ΔH的绝对值均正确) ( )
| A.C2H5OH(l)+3O2(g)===2CO2(g)+3H2O(g)ΔH=+1 367.0 kJ·mol-1(反应热) |
| B.NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l)ΔH=+57.3 kJ·mol-1(中和热) |
| C.S(s)+O2(g)===SO2(g)ΔH=-296.8 kJ·mol-1(反应热) |
| D.2NO2===O2+2NO ΔH=+116.2 kJ·mol-1(反应热) |
下列描述中,不符合生产实际的是( )
| A.电解熔融的氧化铝制取金属铝,用铁作阳极 |
| B.电解法精炼粗铜,用纯铜作阴极 |
| C.电解饱和食盐水制烧碱,用涂镍碳钢网作阴极 |
| D.在镀件上电镀锌,用锌作阳极 |
镍镉(Ni—Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd + 2NiOOH + 2H2O Cd(OH)2 + 2Ni(OH)2。有关该电池的说法正确的是:
Cd(OH)2 + 2Ni(OH)2。有关该电池的说法正确的是:
| A.充电时阳极反应:Ni(OH)2-e- + OH- ="NiOOH" + H2O |
| B.充电过程是化学能转化为电能的过程 |
| C.放电时负极附近溶液的碱性不变 |
| D.放电时电解质溶液中的OH -向正极移动 |