可逆反应2HI(g) H2(g)+I2(g)在密闭容器中进行,当__________不随时间变化时,才能说明反应已达到平衡( )
H2(g)+I2(g)在密闭容器中进行,当__________不随时间变化时,才能说明反应已达到平衡( )
| A.容器内压强 | B.平均相对分子质量 |
| C.各成分含量 | D.混合气体颜色 |
常温下,下列各组离子在指定溶液中一定能大量共存的是
| A.0.1 mol/L的NaOH溶液:K+、AlO2-、SO42-、CO32- |
| B.0.1 mol/LFeCl3溶液:K+、NH4+、I-、SCN- |
| C.0.1 mol/L的Na2CO3溶液:K+、Ba2+、NO3-、Cl- |
| D.c(H+)/c(OH-)=1×1014的溶液:Ca2+、Na+、I-、NO3- |
下列说法正确的是
| A.装饰材料中的甲醛和芳香烃会造成居室污染 |
| B.石蜡油分解产生的气体不能使酸性高锰酸钾溶液褪色 |
| C.分子组成为CH2Cl2和C2H6O的有机物都存在同分异构现象 |
| D.油脂、葡萄糖、蛋白质都是人体重要的营养物质,它们都能发生水解反应 |
已知下表为250C时某些弱酸的电离平衡常数。下图表示常温时,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化。依据所给信息,下列说法正确的是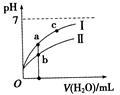
| CH3COOH |
HClO |
H2CO3 |
| Ka=1.8×10-5 |
Ka=3.0×10-8 |
Ka1=4.4×10-7Ka2=4.7×10-11 |
A.相同浓度的CH3COONa和NaClO的混合溶液中,各离子浓度的大小关系是:
C(Na+)>C(ClO—)>C(CH3COO—)>C(OH—)>C(H+)
B.向NaClO溶液中通入少量二氧化碳的离子方程式为:2ClO—+CO2+H2O═2HClO+CO32—
C.a、b、c三点所示溶液中水的电离程度c>a>b
D.图像中,Ⅰ表示CH3COOH,Ⅱ表示HClO,且溶液导电性:c>b>a
下列对有关实验事实的解释或得出的结论合理的是
| 选项 |
实验事实 |
解释或结论 |
| A |
KI淀粉溶液中滴入氯水变蓝,再通入SO2,溶液褪色 |
SO2具有漂白性 |
| B |
将BaSO4浸泡在饱和Na2CO3溶液中,部分BaSO4转化为BaCO3 |
Ksp(BaSO4)>Ksp(BaCO3) |
| C |
某钾盐溶于盐酸,产生无色无味气体,该气体通入澄清石灰水,有白色沉淀出现 |
该钾盐可能是K2CO3 |
| D |
NaI溶液 溶液变蓝色 溶液变蓝色 |
酸性条件下H2O2的氧化性比I2强 |
有机物X的蒸气相对氢气的密度为51,X中氧元素的质量分数为31.7%,则能在碱溶液中发生反应的X的同分异构体有(不考虑立体异构)
| A.15种 | B.13种 | C.11种 | D.9种 |