X、Y、Z为三种气体,把a mol X和b mol Y充入一密闭容器中,发生反应X+2Y 2Z,达到平衡时若它们的物质的量满足:n(X)+n(Y)====n(Z),则Y的转化率为( )
2Z,达到平衡时若它们的物质的量满足:n(X)+n(Y)====n(Z),则Y的转化率为( )
A. ×100% ×100% |
B. ×100% ×100% |
C.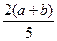 ×100% ×100% |
D. ×100% ×100% |
2014年6月28日,第五期中国科协“科学家与媒体面对面”活动上,医学专家呼吁:过量补锌致儿童性早熟,全民补碘也是不科学的,这里的锌、碘应理解为
| A.单质 | B.分子 | C.元素 | D.同位素 |
下列实验操作能达到实验目的的是
| 实验操作 |
实验目的 |
|
| A |
苯和溴水混合后加入铁粉 |
制溴苯 |
| B |
乙醇与高锰酸钾(KMnO4)酸性溶液混合 |
验证乙醇具有还原性 |
| C |
蔗糖溶液加稀硫酸,水浴加热一段时间后,加新制备的Cu(OH)2悬浊液,加热 |
证明蔗糖水解后产生葡萄糖 |
| D |
向纯碱中滴加醋酸,将产生的气体分别通入饱和NaHCO3溶液、苯酚钠浓溶液 |
证明酸性:醋酸>碳酸>苯酚 |
下列除杂方法中正确的一组是
| A.溴苯中混有溴,加入氢氧化钠溶液,振荡、静置、分液 |
| B.苯中混有苯酚,加浓溴水后过滤 |
| C.乙烷中混有乙烯,通过盛有酸性KMnO4溶液的洗气瓶洗气 |
| D.乙酸乙酯中混有乙酸,可选用饱和Na2CO3溶液,振荡、静置、分液 |
下列说法正确的是
| A.在酸性条件下,CH3CO18OC2H5水解的产物是CH3CO18OH和C2H5OH |
| B.用甘氨酸(H2NCH2COOH)和丙氨酸(CH3CHNH2COOH)混合缩合,最多可形成4种二肽 |
| C.苯甲醛中混有苯甲酸,加入生石灰,再加热蒸馏 |
| D.将电石与饱和食盐水反应生成的气体通入溴的四氯化碳溶液中,若溶液褪色,证明有乙炔生成 |
下图是一些常见有机物的转化关系,以下有关反应的说法正确的是
| A.反应①是加成反应 | B.反应②是加聚反应 |
| C.反应③是消去反应 | D.反应④⑤⑥⑧是取代反应 |