恒压(1.01×105 Pa)下,将2.0 mol SO2与a mol O2的混合气体通入一个容积可变的密闭容器中,发生如下反应:
2SO2(g)+O2(g) 2SO3(g);ΔH<0
2SO3(g);ΔH<0
(1)T1℃下反应达平衡时,测得容器内n(SO3)="1.3" mol,n(O2)="3.0" mol,则a=_______________;平衡时SO2的转化率为__________________。
(2)T2℃下反应达平衡时,混合气体的物质的量共为4.8 mol。T1与T2的关系是___________(选填序号)。
①T1>T2 ②T1<T2 ③T1=T2
【化学一选修5.有机化学基础】
药物卡托普利的合成原料F、工程材料聚碳酸酯(简称PC)的合成路线如图所示:
已知:①
②酯与含羟基的化合物可发生如下酯交换反应:
请回答:
(1)C由丙烯经反应①~③合成,C的核磁共振氢谱只有一种峰。
a.①的反应类型是。
b.②的反应试剂和条件是。
c.③的化学方程式是。
(2)9.4g的D与饱和溴水完全反应生成33.lg白色沉淀,D的结构简式是。
(3)C与D反应生成双酚A的化学方程式。
(4)F有多种同分异构体,满足下列条件的所有同分异构体的结构简式是。
①含有甲基②含有碳碳双键③能发生银镜反应④属于酯
(5)PC的结构简式是。
【化学—选修3:物质结构与性质】
氮化钛( Ti3N4)为金黄色晶体,由于具有令人满意的仿金效果,越来越多地成为黄金代替品。以TiCl4为原料,经过一系列反应(如图所示),可以制得Ti3N4和纳米TiO2请回答下列问题:
(1)反应①为置换反应,写出该反应的化学方程式 ;TiCl4分子中4个氯原子不在同一平面上,则TiCl4的空间构型为 。
(2)元素周期表中Ti元素位于第周期族。与Ti相邻的元素Zr的基态原子外围电子排布式为,
(3)纳米TiO2是一种应用广泛的催化剂,纳米Ti02催化的一个实验如图所示。
化合物甲的分子中采取sp2方式杂化的碳原子个数为,化合物乙中采取sp3杂化的原子的第一电离能由大到小的顺序为。
(4)有一种氮化钛晶体的晶胞如图所示,该氮化钛晶胞中含有个N原子,晶胞中N、Ti之间的最近距离为a pm,则该氮化钛的密度为g.cm-3(NA为阿伏加德常数的数值,只列算式)。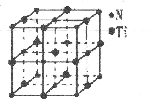
【化学——选修2化学与技术】
生产自来水的流程图所示。
(1) FeSO4·7H2O是常用的混凝剂,它在水中最终生成沉淀。
(2)实验室过滤操作所用到的玻璃仪器是。
(3)我们有时感觉自来水“有漂白粉的气味”,是因为使用了氯气消毒,请写出有关化学方程下列物质中,(填写序号)可以作为氯气的代用品。
①臭氧②NH3(溶液)③K2FeO4④SO2
(4)有些地区的天然水中含有较多的钙、镁离子。用离子交换树脂软化硬水时,先后把水通过分别装有离子交换树脂和离子交换树脂的离子交换柱(填“阴”或 “阳”)。
(5)测定水中的溶解氧:量取20mL水样,迅速加入MnSO4和KOH的混合溶液,再加入KI溶液,立即塞好塞子,振荡使其完全反应。打开塞子,迅速加入适量硫酸溶液,此时有碘单质生成。用0.010mol/L Na2S2O3溶液滴定生成的碘,消耗了6.00mL Na2S2O3溶液。已知在碱性溶液中,氧气能迅速氧化Mn2+,生成物在酸性条件下可以将碘离子氧化为碘单质,本身重新还原为Mn2+。
上述过程发生的反应可表示为:
2Mn2++4OH-+O2=2MnO(OH)2
MnO(OH)2+2I-+4H+=I2+Mn2++3H2O
I2+2S2O32-=2I-+S4O62-
水中的溶解氧量为(以mg·L-l为单位)。
二氧化硫是重要的工业原料,探究其制备方法和性质具有非常重要的意义。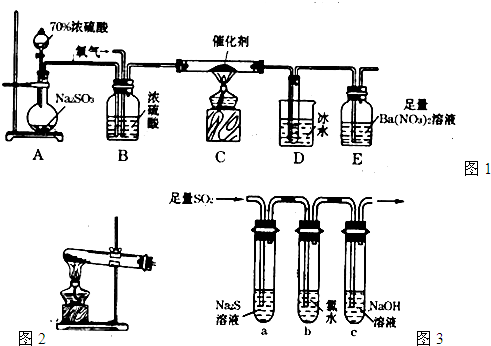
(1)实验室用图1装置测定SO2催化氧化为SO3的转化率。(已知SO3熔点为16.8℃,假设气体进入装置时分别被完全吸收,且忽略空气中CO2的影响。)
①简述使用分液漏斗向圆底烧瓶中滴加浓硫酸的操作:。
②实验过程中,需要通入氧气。试写出一个用如图2所示装置制取氧气的化学方程式:。
③当停止通入SO2熄灭酒精灯后,需要继续通一段时间的氧气,其目的是:。
④实验结束后,若装置D增加的质量为mg,装置E中产生白色沉淀的质量为ng,则此
条件下二氧化硫的转化率是(用含字母的代数式表示,不用化简)。
(2)某学习小组设计用如图3装置验证二氧化硫的化学性质。
①能说明二氧化硫具有氧化性的实验现象为: 。
②为验证二氧化硫的还原性,充分反应后,取试管b中的溶液分三份,分别进行如下实验。
方案I:向第一份溶液中加入AgNO3溶液,有白色沉
淀生成。
方案II:向第二份溶液中加入品红溶液,红色褪去。
方案III:向第三份溶液中加入BaC12溶液,产生白色沉淀
上述方案中合理的是 (填“I”、“II”、或“III”);
试管b发生反应的离子方程式:。
③当通入二氧化硫至试管c中溶液显中性时,该溶液中
c(Na+)=(用含硫微粒浓度的代数式表示)。
运用化学反应原理分析解答以下问题
(1)已知:①CO(g)+2H2(g) CH3OH(g)△Hl= -91kJ·mol-l
CH3OH(g)△Hl= -91kJ·mol-l
②2CH3OH(g) CH3OCH3(g)+H2O(g)△H2= -24 kJ·mol-l③CO(g) +H2O(g)
CH3OCH3(g)+H2O(g)△H2= -24 kJ·mol-l③CO(g) +H2O(g)  CO2(g)+H2(g)△H3= -41 kJ·mol-l
CO2(g)+H2(g)△H3= -41 kJ·mol-l
且三个反应的平衡常数依次为K1、K2、K3 则反应 3CO(g) +3H2(g) CH3OCH3(g) +CO2(g)△H=.
则反应 3CO(g) +3H2(g) CH3OCH3(g) +CO2(g)△H=.
化学平衡常数K=(用含K1、K2、K3的代数式表示)。
(2)一定条件下,若将体积比为1:2的CO和H2气体通入体积一定的密闭容器中发生反应 3CO(g) +3H2(g) CH3OCH3(g) +CO2(g),下列能说明反应达到平衡状态是。
3CO(g) +3H2(g) CH3OCH3(g) +CO2(g),下列能说明反应达到平衡状态是。
a.体系压强保持不变 B.混合气体密度保持不变
c. CO和H2的物质的量保持不变 d.CO的消耗速度等于CO2的生成速率
(3)氨气溶于水得到氨水。在25℃下,将x mol.L-l的氨水与y mol.L-1的盐酸等体积混合,反应后溶液显中性,则c(NH4+)____c(Cl-)(填“>”、“<”、“=”);用含x和y的代数式表示出氨水的电离平衡常数.
(4)科学家发明了使NH3直接用于燃料电池的方法,其装置用铂黑作电极、加入电解质溶液中,一个电极通入空气,另一电极通入NH3。其电池反应式为:4NH3+3O2 = 2N2+6H2O,电解质溶液应显(填“酸性”、“中性”、“碱性”),
写出正极的电极反应方程式.