铁酸钠(Na2FeO4)是水处理过程中使用的一种新型净水剂,它的氧化性比高锰酸钾更强,本身在反应中被还原为Fe3+。
(1)配平制取铁酸钠的化学方程式:
□Fe(NO3)3+□NaOH+□Cl2——□Na2FeO4+□NaNO3+□NaCl+□H2O
反应中_____________________元素被氧化,转移电子总数为__________________________。
(2)铁酸钠之所以能净水,除了能消毒杀菌外,另一个原因是________________________
_______________________________________________________________________________。
小刚收集到一瓶浑浊的南湖水,他要模拟自来水厂的净水过程,最终制成蒸馏水,其实验过程如下所示。请回答以下问题。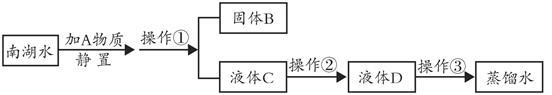
实验中3个操作的装置图如下: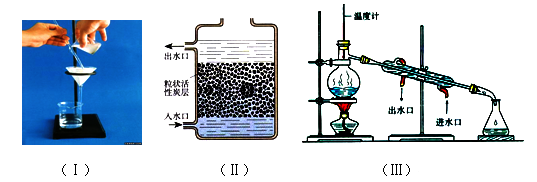
(1)加入A物质是为了使南湖水中悬浮的杂质沉降,A物质的名称是 ,操作①的名称是 。
(2)操作②主要是除去一些异味和色素,应选用的装置是 (填序号“Ⅰ”、“Ⅱ”或“Ⅲ”,下同)。
(3)小刚取少量液体D于试管中,加入少量肥皂水,振荡,发现没有泡沫产生,说明液体D是 (填“硬水”或“软水”),操作③应选用的装置是 在日常生活中,常采用 的方法降低水的硬度。
(4)电解水的反应文字表达式是 ,电解时,在水中加入少量硫酸钠的目的是 ;与正极相连的玻璃管上方产生的气体是 ,反应停止后,正极与负极产生的气体体积比约为 ,该反应中不可再分的微粒是 。
老师为同学们提供了如下实验装置: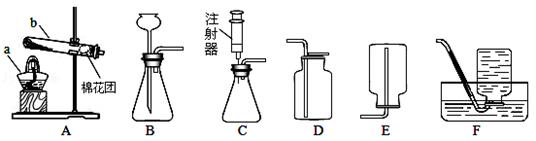
(1)写出仪器名称:a是 ,b是 。
(2)组装仪器时,将玻璃导管插入胶皮管或带孔橡胶塞前,要先把玻璃管口用 润湿,然后稍稍用力旋转,将其插入。
(3)某同学用高锰酸钾制取并用排水法收集一瓶氧气,选用的发生装置是 (填字母序号),反应表达式为 ;试管口要塞一小团棉花的其目是 。实验前必须检查 ;实验结束停止加热时,先要将 ,然后 ,否则会引起 。
(4) 实验室也可以选用过氧化氢溶液和二氧化锰在装置B中制取氧气,反应表达式为 ,若选用C做发生装置,你认为选用装置C的优点是 。
用数字和化学符号表示:
(1)2个氧原子 ;(2)3个氢分子 ;
(3)氯离子 ;(4)氧化铜 ;(5)+2价的钙元素 ;
(6)根据下列要求,用文字表达式表示有关反应。
①硫在氧气中燃烧 。
②铁丝在氧气中燃烧 。
实验室有两瓶失去标签的无色液体,它们可能是蒸馏水和过氧化氢溶液,请你设计实验将它们区分出来。
| 实 验 操 作 |
实 验 现 象 |
实 验 结 论 |
实验室常利用以下装置完成气体制备及性质实验。请回答:
(1)指出编号仪器的名称:① ,② 。
(2)若用A图做发生装置是来制取氧气,则反应的符号表达式为 ,反应类型为 ;若使用C装置收集氧气,实验结束时,应先 ,再 ,原因是 。
(3)实验室也常用氯酸钾制取氧气,反应的符号表达式为________________。
(4)硫化氢(H2S)是一种有刺激性气味、有毒的、密度比空气大的无色气体,能溶于水。实验室通常用硫化亚铁固体和稀硫酸(液体)反应来制取它。实验室制取H2S选择的发生装置是 。