本题中所有的气体体积均为标准状况下的体积。A、B为两种单质,常温下均是固体。在元素周期表中A、B同周期且原子半径A>B。分别取三份质量为1.52 g的A、B的混合物(粉末)进行如下实验:
a.向第一份试样中加入过量的盐酸,充分反应后,放出0.896 L气体,还剩下0.56 g的残渣;
b.向第二份试样中加入过量的10%的NaOH溶液,充分反应后,放出0.896 L气体,还剩下0.96 g的残渣;
c.将第三份试样隔绝空气加强热后,生成一种固体,冷却后,再加入足量的盐酸,该固体全部溶解,产生x L气体。
(1)单质B是__________________。
(2)混合物中A的质量分数是__________________。
(3)写出实验c中有关反应的化学方程式并计算x的值。
化合物KxFe(C2O4)y·3H2O(Fe为+3价)是一种光敏材料,实验室可以用如下的方法来制备这种材料并测定这种材料的组成。 Ⅰ.制备
Ⅰ.制备
K2C2O4
FeCl3
(1)结晶时应将溶液用冰水冷却并在黑暗处等待晶体的析出,这样操作的原因是:__________________。
(2)操作Ⅲ的名称是___________。
Ⅱ.组成测定
称取一定质量的晶体置于锥形瓶中,加入足量的蒸馏水和稀H2SO4,将C2O42-转化为H2C2O4后用0.1000 mol·L-1KMnO4溶液滴定,当消耗KMnO4溶液24.00mL时恰好完全反应;再向溶液中加入适量的还原剂,恰好将Fe3+完全转化为Fe2+,用KMnO4溶液继续滴定,当Fe2+完全氧化时,用去KMnO4溶液4.00mL。第二次滴定的离子化学方程式为:
_______________________________________________________
(3)配制100mL 0.1000 mol·L-1KMnO4溶液及滴定实验中所需的玻璃仪器除烧杯、玻璃棒、胶头滴管、量筒、锥形瓶外还有_______________________________(填仪器名称)。
(4)该化合物KxFe(C2O4)y·3H2O中,x=_______。
向0.1mol/L的草酸(H2C2O4)溶液中逐滴加入酸性高锰酸钾溶液时,溶液褪色总是先慢后快。对其原因,某研究性学习小组结合化学反应原理提出猜想与假设,并设计了一系列实验进行探究:
| 实验组别 |
试管标号 |
所加药品 |
实验现象 (褪色时间) |
| 一 (室温) |
1 |
10ml 0.1mol/L的草酸(H2C2O4)溶液(用少量硫酸酸化)0.1mol/L的KMnO4溶液适量 +少量硫酸锰固体 |
2s |
| 2 |
10ml 0.1mol/L的草酸(H2C2O4)溶液(用少量硫酸酸化)0.1mol/L的KMnO4溶液适量 |
30s |
|
| 二 (室温) |
1 |
5ml 0.1mol/L的草酸(H2C2O4)溶液 5滴0.1mol/L的KMnO4溶液+10滴稀硫酸 |
90s |
| 2 |
5ml 0.1mol/L的草酸(H2C2O4)溶液 5滴0.1mol/L的KMnO4溶液 |
100s |
|
| 三 (65℃ 的水浴) |
1 |
5ml 0.1mol/L的草酸(H2C2O4)溶液 5滴0.1mol/L的 KMnO4溶液 +10滴稀硫酸 |
90s |
| 2 |
5ml 0.1mol/L的草酸(H2C2O4)溶液 5滴0.1mol/L的KMnO4溶液 +1ml稀硫酸 |
100s |
|
| 3 |
5ml 0.1mol/L的草酸(H2C2O4)溶液 5滴0.1mol/L的KMnO4溶液 +2ml稀硫酸 |
120s |
(1) 该研究性学习小组的实验目是:。
(2)该研究性学习小组进行实验时所用的方法是科学实验中常用的一种方法,该方法
叫法;
(3)设计第一组实验对应的假设是;
(4)由第二组实验和第三组实验得出的结论有(填序号)
①温度对该反应速率影响不大
②硫酸对草酸和高锰酸钾溶液的反应有影响
③加入少量硫酸,可以促进草酸和高锰酸钾溶液的反应,而加入大量硫酸,反应速率比较慢
④在酸性范围呢,PH值越小,可能对反应越有利
(5)据有关现象写出草酸溶液与酸性高锰酸钾溶液反应的离子方程式:
。
实验室用浓硫酸与铜的反应制取少量NaHSO3,实验装置如下图所示: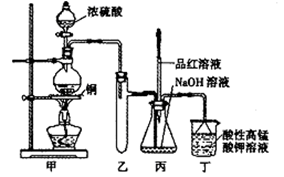
请回答:
(1)实验中取一定量Cu片和一定量浓H2SO4放在圆底烧瓶中共热,至反应结束后,发现烧瓶中还有少量Cu剩余,有人认为还有一定量的H2SO4剩余,原因是
,在不增加浓H2SO4的前提下,若使剩余铜片溶解可再加入(填写两种属于不同类别的物质)。
(2)向反应后的溶液中加入足量的CuO,使剩余的H2SO4全部转化为CuSO4,过滤后将滤液加热浓缩,冷却结晶制得硫酸铜晶体(CuSO4·XH2O)某小组同学采用加热法测定该晶体里结晶水X的值;
①在他们的实验操作中至少称量次。
②下面是其中一次实验的数据
| 坩埚质量 |
坩埚与晶体总质量 |
加热后坩埚与固体总质量 |
| 11.7g |
22.7g |
18.6g |
根据上表数据计算判断x的实测值比理论值(x=5)(填“偏大”或“偏小”)。
(3)装置乙的作用是:;
(4)下列说法正确的是:(填序号)。
a.甲装置使用的玻璃仪器有:酒精灯、玻璃管、长颈漏斗、圆底烧瓶
b.KMnO4溶液用于尾气处理
c.当把品红溶液滴入到锥形瓶中,若品红不褪色,说明无NaHSO3产生
d.当把品红溶液滴入到锥形瓶中,若品红褪色,说明NaOH已完全转化为NaHSO3
e.若把品红溶液换成酸性高锰酸钾溶液,并滴入到锥形瓶中,不显紫红色,说明NaOH已完全转化为NaHSO3
f.此装置换上其它药品后,不能制取和收集少量纯净的氯气
 —锂辉石的主要成分是Li2O·Al2O3·4SiO2,还含有FeO、CaO、MgO等。
—锂辉石的主要成分是Li2O·Al2O3·4SiO2,还含有FeO、CaO、MgO等。
以 —锂辉石为原料制备碳酸锂的一种流程如下:
—锂辉石为原料制备碳酸锂的一种流程如下: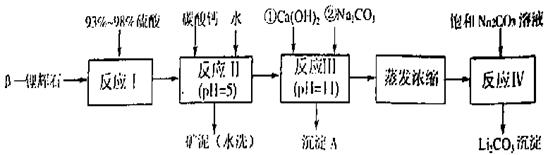
已知:①部分金属氢氧化物开始沉淀和完全沉淀的pH:
| 氢氧化物 |
Fe(OH)3 |
Al(OH)3 |
Mg(OH)2 |
| 开始沉淀pH |
2.7 |
3.7 |
9.6 |
| 完全沉淀pH |
3.7 |
4.7 |
11 |
②Li2CO3在不同温度的溶解度如下表:
| 温度/℃ |
0 |
10 |
20 |
50 |
75 |
100 |
| Li2CO3的溶解度/g |
1.539 |
1.406 |
1.329 |
1.181 |
0.866 |
0.728 |
回答下列问题:
(1)反应II中加碳酸钙的作用是。
(2)写出反应III中生成沉淀A的离子方程式、。
(3)写出反应IV的化学方程式。洗涤所得Li2CO3沉淀要用热水而非冷水,原因是。
(4)实验室中常用于蒸发浓缩的硅酸盐质的仪器有______________。
| A.蒸发皿 | B.玻璃棒 | C.铁架台(带铁圈) | D.酒精灯 E、圆底烧瓶 |
工业上常采用天然矿物法生产硝酸钾,工艺流程如下图所示,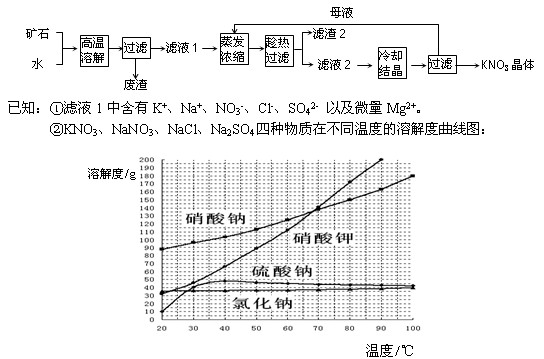
回答下列问题:
(1)“滤渣2”的主要成分是。
(2)“母液”多次循环使用会造成产品纯度降低,处理的方法是:在多次循环后的“母液”中加入NaOH溶液,其反应原理是
(用离子反应方程式表示)
(3)在滤液1蒸发浓缩过程中,可加入适量的KCl固体,提高产品的产量,原因是;
(4)若要进一步提高硝酸钾晶体的纯度,还必须进行的操作是:
。