由铜片、锌片和200 mL稀H2SO4组成的原电池中,若锌片发生电化学腐蚀,当铜片上放出3.36 L(标准状况)气体时,硫酸恰好全部作用完。试计算:
(1)产生这些气体消耗了多少克锌?
(2)有多少个电子通过了导线?
(3)200 mL稀H2SO4的物质的量浓度是多少?
将 和
和 在适宜条件下按下式进行反应
在适宜条件下按下式进行反应

 ,当在某
,当在某 一温度下达到化学平衡状态,试解答:
一温度下达到化学平衡状态,试解答:
(1)若测得平衡混合气体对空气的相对密度为0.6时,求 的转化率.
的转化率.
(2)若测得平衡混合气体对空气的相对密度为0.47时,求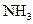 在平衡混合气体中体积分数.
在平衡混合气体中体积分数.
把10.2 g镁铝合金的粉末放入过量的盐酸中,得到11.2 L H2(标准状况下)。试
计算:(原子量:Mg—24、Al—27)
(1)该合金中镁的质量分数。
(2)该合金中镁与铝的物质的量之比。
(3)该合金溶于足量的烧碱溶液中,产生H2的体积(标准状况下)是多少?
实验室常用的浓盐酸物质的量浓度约为12.0mol·L-1。
(1)实验室欲用上述浓盐酸配制480mL 0.20 mol·L—1的稀盐酸溶液,则需要取上述浓盐酸
mL?
(2)配制过程中,不需要的仪器(填写代号)▲。
A.药匙 B.胶头滴管 C.玻璃棒 D.烧杯
完成实验还缺少的仪器是▲。
(3)取用任意体积的所配0.20 mol·L-1 HCl溶液时,下列物理量中不随所取体积的多少而变化的是▲(填字母)
A.溶液中HCl的物质的量 B.溶液的浓度
C.溶液中Cl—的数目 D.溶液的密度
(4)用15.8g KMnO4氧化足量的上述浓盐酸。反应方程式如下:
2KMnO4 + 16HCl =" 2KCl" + 2Mn Cl 2 + 5Cl 2↑+ 8H2O
Cl 2 + 5Cl 2↑+ 8H2O
则:①有多少摩尔HCl被氧化?
②产生的Cl 2在标准状况下的体积为多少?
某有机化合物A含碳77.8%,氢为7.40%,其余为氧,A的相对分子质量为甲烷的6.75倍。求:
⑴该有机物的分子式。
⑵红外光谱测定,A分子结构中含有苯环和羟基。在常温下A可与浓溴水反应,1molA最多可与2molBr2作用,据此确定该有机物可能的结构简式。
欲使100g 9.32 % 的NaOH溶液溶质的质量分数增大到20%
(1)需往溶液中加入多少克金属钠?
(2)若20%NaOH溶液的密度为1.066 g/cm3,计算物质的量浓度。