工业制硫酸尾气中的SO2回收常采用氨吸收法。即先用氨水吸收尾气中的SO2,化学方程式为:
SO2+2NH3+H2O====(NH4)2SO3
(NH4)2SO3+SO2+H2O====2NH4HSO3
当吸收液中NH4HSO3达到一定浓度后,再与硫酸反应。放出的SO2可循环利用,生成的(NH4)2SO4可作化肥。化学方程式是:2NH4HSO3+H2SO4====(NH4)2SO4+2SO2↑+2H2O
(NH4)2SO3+H2SO4====(NH4)2SO4+SO2↑+H2O
每生成1 mol(NH4)2SO4,回收SO2的体积(标准状况下)可能为( )
| A.22.4 L | B.33.6 L | C.44.8 L | D.56 L |
鉴别淀粉、蛋白质、葡萄糖水溶液,依次所用试剂和对应的现象正确的是()
| A.碘水,变蓝色;浓硝酸,变黄色;新制氢氧化铜,砖红色沉淀 |
| B.浓硝酸,变黄色;新制氢氧化铜,砖红色沉淀;碘水,变蓝色 |
| C.新制氢氧化铜,砖红色沉淀;碘水,变蓝色;浓硝酸,变黄色 |
| D.碘水,变蓝色;新制氢氧化铜,砖红色沉淀;浓硝酸,变黄色 |
已知反应X+Y= M+N为吸热反应,对这个反应的下列说法中正确的是()
| A.X的能量一定低于M的能量,Y的能量一定低于N的能量 |
| B.X和Y的总能量一定低于M和N的总能量 |
| C.破坏反应物中的化学键所吸收的能量小于形成生成物中化学键所放出的能量 |
| D.因为该反应为吸热反应,故反应一定要加热才能进行 |
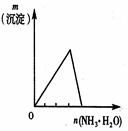
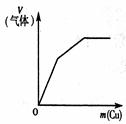
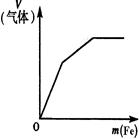
下列反应中,相关示意图像错误的是()
| A |
B |
C |
D |
| 将二氧化硫通入到一定量氯水中 |
将氨水滴入到一定量氯化铝溶液中 |
常温下将铜粉加入到一定量浓硝酸中 |
常温下将铁粉加入到一定量浓硝酸中 |
 |
 |
 |
 |
将等体积的四氯化碳、溴苯和水在试管中充分混合后静置。下列图示现象正确的是()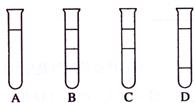
在a LAl2(SO4)3和(NH4)2SO4的混合溶液中加入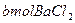 ,恰好使溶液中的SO42—离子完全沉淀;如加入足量强碱并加热可得到c mol NH3,则原溶液中的Al3+浓度(mol/L)为()
,恰好使溶液中的SO42—离子完全沉淀;如加入足量强碱并加热可得到c mol NH3,则原溶液中的Al3+浓度(mol/L)为()
A.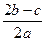 |
B. |
C.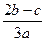 |
D. |