区别强弱电解质的标准是( )
| A.化合物水溶液的导电性 |
| B.在水中化合物的溶解度 |
| C.化合物在水溶液中的电离程度 |
| D.化合物溶于水后是否与水反应生成能电离的物质 |
下列现象与胶体的性质无关的是
| A.将盐卤或石膏加入豆浆,制成豆腐 |
| B.向FeCl3溶液中加入NaOH溶液,会出现红褐色沉淀 |
| C.一枝钢笔使用两种不同型号的蓝黑墨水,易出现堵塞 |
| D.清晨,人们经常看到的阳光穿过茂密的树木枝叶所产生的美丽景象 |
一化学兴趣小组在家中进行化学实验,按照图1连接好线路发现灯泡不亮,按照图2连接好线路发现灯泡亮,由此得出的结论正确的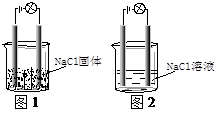
| A.NaCl是非电解质 |
| B.NaCl溶液是电解质 |
| C.NaCl在水溶液中电离出自由移动的离子 |
| D.NaCl在通电时电离出自由移动的离子 |
设NA表示阿伏加德罗常数,下列说法正确的是
| A.1 mol氦气中有2NA个氦原子 |
| B.18 g水中所含的电子数为10NA |
| C.0.3 mol·L-1Na2SO4溶液中含0.6NA个Na+ |
| D.11.2L氮气中含NA个氮原子 |
下列各组物质,按化合物、单质、混合物顺序排列的是
| A.生石灰、白磷、熟石灰 | B.烧碱、液态氧、碘酒 |
| C.干冰、铁、硫酸 | D.盐酸、氮气、胆矾 |
下列实验操作中错误的是
| A.提取碘水中的碘单质时,应选择有机萃取剂,且萃取剂与水不互溶 |
| B.蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶支管口处,且冷凝水方向应当由下往上 |
| C.分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
| D.蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热 |