血液中含葡萄糖(血糖)过高会引发糖尿病,低血糖又会导致人易发生昏厥。正常人的血糖应为3.9—6.2 mmol·L-1。某学生验血后得知其血糖的质量分数为0.1%。已知葡萄糖的相对分子质量为180,若血液的密度为1 g·cm-3,则该学生血液中血糖的物质的量浓度是否符合正常人的范围?(通过计算完成)(注:1 mmol=1×10-3 mol)
为了消除人体碘缺乏病,我国政府规定食用盐必须是加碘食盐,简称碘盐。所谓碘盐就是在食盐中加入一定量的碘酸钾(KIO3),请计算(精确到0.1):
(1)碘酸钾中碘元素的质量分数。
(2)若成人每天食用7 g碘盐,从中摄取0.15 mg碘,那么1 kg碘盐中含碘多少毫克?
(3)我国规定每千克食盐中碘酸钾的含量在0.06—0.08 g。某研究小组称取食盐样品100 g,加入足量碘化钾发生反应:KIO3+5KI+3H2SO4====3K2SO4+3I2+3H2O,测得生成碘单质0.0254 g,请计算1 000 g样品中KIO3的含量,并判断样品是否符合国家标准。
世界卫生组织把铝列为食品污染源之一,成人每日摄入铝元素的量应控制在0.004 g以下。油条是中国北方常用的食品之一,每270 g油条中约含0.9 g明矾〔KAl(SO4)2·12H2O,其相对分子质量为474〕。试通过计算说明,若成人每日食用142.2 g油条,铝元素的摄入量是否会超过安全摄入量?
(9分)为了预防碘缺乏病,国家规定每千克食盐中应含有40—50 mg的碘酸钾。为检验某种食盐是否为加碘的合格食盐,某同学取食盐样品428 g,设法溶解出其中全部的碘酸钾。将溶液酸化并加入足量的碘化钾淀粉溶液,溶液呈蓝色,再用0.030 mol·L-1的硫代硫酸钠溶液滴定,用去18.00 mL时蓝色刚好褪色。试通过计算说明该加碘食盐是否为合格产品。有关反应如下: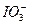 +5I-+6H+====3I2+3H2O
+5I-+6H+====3I2+3H2O
I2+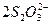 ====2I-+
====2I-+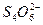
(12分)关心父母是青少年的美德。学生小王为他患糖尿病的父母制作了一张食谱,为评价该食谱,他获得了下列资料。请阅读资料回答下列问题。
糖尿病原菌的致病原因之一是胰岛素缺乏。主要表现为血糖增高,合理的饮食是治疗糖尿病的基础,肥胖者要限制热量,减轻体重;消瘦者要有足够的热量以恢复理想的体重。饮食中碳水化合物所提供的热量不要高于总热量的55%—60%,胆固醇每日摄入量要低于300 mg,糖的食用要有节制。(资料来源:《中国大百科全书》)
专家对该类病人每日主要营养成分的推荐摄入量和上图食谱的实测数据如下表。
| 专家推荐摄入量 |
上图食谱实测数据 |
|
| 蛋白质(g) |
93 |
80 |
| 脂肪(g) |
70 |
50 |
| 碳水化合物(g) |
330 |
450 |
| 总热量(kJ) |
9 851 |
10 910 |
(1)已知每克蛋白质、脂肪、碳水化合物分别产生17 kJ、38 kJ、17 kJ热量;该食谱中蛋白质、脂肪和碳水化合物所提供的热量占总热量的百分比分别是:_________、_________和_________。
(2)通过对上题数据的分析,小王得到的结论是____________________________________。
(3)如果要对该食谱进行较为全面的分析,还需要的数据有__________________________。
(4)小王对食谱的评价过程包括,_________和_________得出结论等三个环节。