某溶液中有Cu2+、NH4+、Fe2+和Al3+四种离子,若向其中加入过量的氢氧化钠溶液,微热并搅拌,再加入过量盐酸,溶液中大量减少的阳离子是
| A.Cu2+ | B.NH4+ | C.Fe2+ | D.Al3+ |
下列反应达到平衡后,加压或升温,平衡都向正反应方向移动的是
A.N2(g)+3H2(g) 2NH3(g) △H<0 2NH3(g) △H<0 |
B.3O2(g) 2O3(g)△H>0 2O3(g)△H>0 |
C.H2(g)+I2(g) 2HI(g)△H<0 2HI(g)△H<0 |
D.NH4HCO3(s) NH3(g)+H2O(g)+CO2(g) △H>0 NH3(g)+H2O(g)+CO2(g) △H>0 |
一定条件下,在一恒容密闭容器中,能表示反应 X(g)+2Y(g)  2Z(g) 一定达到化学平衡状态的是
2Z(g) 一定达到化学平衡状态的是
① 容器中气体的密度不再发生变化 ② X、Y、Z的浓度不再发生变化
③ 容器中的压强不再发生变化 ④ 单位时间内生成n mol Z,同时生成2n mol Y
| A.①② | B.②③ | C.③④ | D.①④ |
在一定条件下,对于A2(g)+3B2(g)  2AB3(g)反应来说,以下化学反应速率的表示中,化学反应速率最快的
2AB3(g)反应来说,以下化学反应速率的表示中,化学反应速率最快的
| A.v(A2)=0.8 mol·L-1·s-1 | B.v(A2)=30 mol·L-1·min-1 |
| C.v(AB3)=1.0 mol·L-1·s-1 | D.v(B2)=1.2 mol·L-1·s-1 |
试判断下列哪个装置中灯泡会亮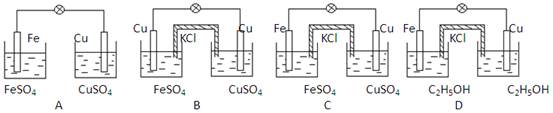
“活化分子”是衡量化学反应速率快慢的重要依据,下列对“活化分子”的说法不正确的是
| A.活化分子之间的碰撞一定是有效碰撞 |
| B.增大反应物的浓度,可使单位体积内活化分子增多,反应速率加快 |
| C.对于有气体参加的反应缩小体积,可使单位体积内活化分子增多,反应速率加快 |
| D.催化剂能降低反应的活化能,使单位体积内活化分子百分数大大增加 |