已知I-、Fe2+、SO2、Cl-和H2O2均有还原性,它们在酸性溶液中还原性强弱的顺序为Cl-<Fe2+<H2O2<I-<SO2,则下列反应不能发生的是( )
A.2Fe3++SO2+2H2O====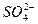 +4H++2Fe2+ +4H++2Fe2+ |
B.I2+SO2+2H2O====H2SO4+2HI |
C.H2O2+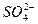 +2H+====SO2↑+O2↑+2H2O +2H+====SO2↑+O2↑+2H2O |
D.2Fe3++2I-====2Fe2++I2 |
用NA表示阿伏加德罗常数,下列叙述中正确的是( )
| A.0.1mol·L-1稀硫酸100mL中含有硫酸根个数为0.1NA |
| B.1molCH3+(碳正离子)中含有电子数为10NA |
| C.2.4g金属镁与足量的盐酸反应,转移电子数为 2NA |
| D.12.4g白磷中含有磷原子数为0.4NA |
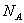 代表阿伏加德罗常数值,下列说法正确的是( )
代表阿伏加德罗常数值,下列说法正确的是( )
A.9g重水所含有的电子数为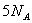 |
B.1mol MgCl2中含有离子数为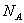 |
C.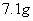 氯气与足量NaOH溶液反应转移的电子数为 氯气与足量NaOH溶液反应转移的电子数为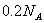 |
D.1molC10H22分子中共价键总数为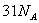 |
强酸与强碱的稀溶液发生中和反应的热效应:H+(aq)+OH-(aq)=H2O(l);△H=-57.3kJ/mol,向1L0.5mol·L-1的NaOH溶液中加入下列物质:①稀醋酸;②浓H2SO4;③稀硝酸,恰好完全反应的热效应△H1、△H2、△H3的关系正确的是( )
| A.△H1>△H2>△H3 |
| B.△H1<△H3<△H2 |
| C.△H1=△H3>△H2 |
| D.△H1>△H3>△H2 |
在同温同压下,下列各组热化学方程式Q2>Q1的是( )
| A.2H2(g)+O2(g)=2H2O(l);△H=-Q1 2H2(g)+O2(g)=2H2O(g);△H=-Q2 |
| B.S(g)+O2(g)=SO2(g);△H=-Q1 S(s)+O2(g)=SO2(g);△H=-Q2 |
C.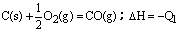 C(s)+O2(g)=CO2(g);△H=-Q2 |
| D.H2(g)+Cl2(g)=2HCl(g);△H=-Q1 |
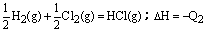
X、Y二元素的原子,当它们分别获得两个电子形成稀有气体元素原子层结构时,X放出的热量大于Y放出的热量;Z、W两元素的原子,当它们分别失去一个电子形成稀有气体元素原子的电子层结构时,吸收能量W大于Z。则X、Y和Z、W分别形成的化合物中,离子化合物可能性最大的是( )
| A.Z2X | B.Z2Y | C.W2X | D.W2Y |