某温度下,在2L的密闭容器中,加入1molX(g)和2molY(g)发生反应:X(g) + m Y(g) 3Z(g),平衡时,X、Y、Z的体积分数分别为30%、60%、10%。在此平衡体系中加入1molZ(g),再次达到平衡后,X、Y、Z的体积分数不变。下列叙述不正确的是
3Z(g),平衡时,X、Y、Z的体积分数分别为30%、60%、10%。在此平衡体系中加入1molZ(g),再次达到平衡后,X、Y、Z的体积分数不变。下列叙述不正确的是
| A.m=2 |
| B.两次平衡的平衡常数相同 |
| C.X与Y的平衡转化率之比为1:1 |
| D.第二次平衡时,Z的浓度为0.4 mol·L-1 |
下列叙述中,不能用勒夏特列原理解释的是
| A.红棕色的NO2加压后颜色先变深后略变浅 |
| B.在H2O2溶液中加入MnO2后产生气泡的速率加快 |
| C.合成氨时及时将氨从反应体系中分离出去,可提高原料的利用率 |
| D.打开汽水瓶,看到大量的气泡逸出 |
下列鉴别方法不可行的是
| A.用水鉴别乙醇、乙酸 |
| B.用燃烧法鉴别乙醇和四氯化碳 |
| C.用碳酸钠溶液鉴别乙醇、甲苯 |
| D.用酸性高锰酸钾溶液鉴别苯、环已烯 |
已知H2O2在催化剂作用下分解速率加快,其能量随反应进程的变化如下图所示。下列说法正确的是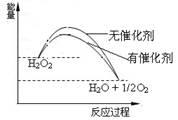
| A.加入催化剂,减小了反应的热效应 |
| B.加入催化剂,可提高H2O2的平衡转化率 |
| C.H2O2分解的热化学方程式: H2O2 = H2O + 1/2O2△H<0 |
| D.反应物的总能量高于生成物的总能量 |
下列说法中,错误的是
| A.反应的平衡转化率能表示在一定温度和一定起始浓度下反应进行的限度 |
| B.金属在发生电化学腐蚀的过程中,总是作为原电池负极的金属被氧化而腐蚀 |
| C.如果某化学反应的△H和△S均小于0,则反应一定能自发进行 |
| D.SO2催化氧化时,加入过量O2时可提高SO2的转化率 |