硫与热的浓NaOH溶液反应的化学方程式为3S+6NaOH  2Na2S+Na2SO3+3H2O。当有1mol硫发生反应时,被还原的硫有( )
2Na2S+Na2SO3+3H2O。当有1mol硫发生反应时,被还原的硫有( )
| A.0.5mol | B.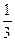 mol mol |
C. mol mol |
D.1mol |
都能用右图所示装置进行喷泉实验的一组气体是(注:烧杯内为NaOH溶液)()
| A.HCl和CO2 | B.NH3和CH4 |
| C.SO2和CO | D.NO2和NO |
“摇摇冰”是一种即用冷的饮料,吸食时将饮料罐隔离层中的化学物质和水混合后摇动即会致冷。该化学物质是()
A NaCl B NH4NO3(s) C NaOH(s) D CaO(s)
下面是实验室制取氨气的装置和选用的试剂,其中错误的是()
 |
A. B. C. D.
在下列变化①大气固氮②硝酸银分解③实验室制取氨气中,按氮元素被氧化、被还原、既不被氧化又不被还原的顺序排列,正确的是()
| A.①②③ | B.②①③ | C.③②① | D.③①② |
氮气与其他单质化合一般需要高温,有时还需高压等条件,但金属锂在常温、常压下就能与氮气化合生成氮化锂,这是因为()
①此反应可能是吸热反应
②此反应可能是放热反应
③此反应可能是氮分子不必先分解成为原子④此反应前可能氮分子先分解成为原子
| A.①② | B.②④ | C.②③ | D.①④ |