海水占地球总储水量的97.2%,若把海水淡化和化工生产结合起来,既可解决淡水资源缺乏的问题,又可充分利用海洋资源。

(1)目前,国际上实用的“海水淡化”主要技术之一是蒸馏法。蒸馏法是将海水变成蒸汽,蒸汽经冷却而得高纯度淡水。由此可判断蒸馏法是 (填:物理变化或化学变化)。
(2)工业上利用电解饱和食盐水可制得重要化工产品。反应式为:食盐+H2O ® NaOH+H2+Cl2(未配平),该反应中食盐的化学式是 ;利用电解所得气体制36.5%的浓盐酸1000 t,最少需消耗食盐 t。
(3)近年来,有人提出了一种利用氯碱工业产品及氯化钠循环治理含二氧化硫废气并回收二氧化硫的方法。该方法流程如下:
请写出②④的化学反应方程式: 、 。
氯酸钾热分解是实验室制取氧气的一种方法,某探究小组查阅资料得知,氯酸钾在不同条件下分解结果如下:
| 实验 |
反应体系 |
第一放热峰温度(℃) |
第二放热峰温度(℃) |
| l |
KC1O3 |
400(无气体放出) |
480(有少量气体放出) |
| 2 |
KC1O3+MnO2 |
350(有大量气体放出) |
已知实验1在480℃时反应方程式为KClO4 KCl+2O2↑,请写出在400℃的化学反应方程式(提示:反应中只有氯元素的化合价改变)。
KCl+2O2↑,请写出在400℃的化学反应方程式(提示:反应中只有氯元素的化合价改变)。
该小组同学利用实验2来制取氧气时,在实验中发现生成的气体略带颜色、并有刺激性气味。
【提出问题】实验中生成的气体中除了氧气外还含有什么物质?
【查阅资料】1.二氧化氯常温下是黄色有强烈刺激性气味的气体
2.二氧化氯具有强氧化性,在溶液中能够把二价锰氧化成四价锰,使之形成不溶于水的二氧化锰(2ClO2+5Mn2++6H2O=5MnO2↓+12H++2Cl—),而氯气不能。
【提出假设】假设l:含有氯气;假设2:含有二氧化氯。
【设计实验】甲同学设计实验验证假设1成立。
| 实验步骤 |
实验现象 |
实验结论 |
| 将产生的气体接触湿润的淀粉碘化钾试纸 |
假设l正确 |
乙同学设计实验验证假设2成立。
| 实验步骤 |
实验现象 |
实验结论 |
| 假设2正确 |
【思考与交流】你同意他们的实验方案吗,理由是。
50 mL 0.50 mol/L盐酸与50 mL 0.55 mol/L NaOH溶液在如图所示的装置中进行中和反 应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题: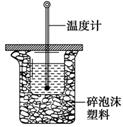
(1)从实验装置上看,图中尚缺少的一种玻璃用品是________;
(2)用相同浓度和体积的醋酸代替稀盐酸溶液进行实验,求得的中和热数值________(填“偏 大”、“偏小”或“无影响”);
(3)实验中改用60 mL 0.50 mol/L 盐酸跟50 mL 0.55 mol/L NaOH溶液进行反应,与上述实验相比,所放出的热量________(填“相等”或“不相等”),所求中和热________(填“相等”或“不相等”),简述理由________________________________________________________。
(12分)正丁醛是一种化工原料。某实验小组利用如右装置合成正丁醛。发生的反应如下: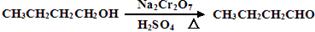 。反应物和产物的相关数据列表如下:
。反应物和产物的相关数据列表如下:
| 沸点/℃ |
密度/g·cm-3 |
水中溶解性 |
|
| 正丁醇 |
117.2 |
0.8109 |
微溶 |
| 正丁醛 |
75.7 |
0.8017 |
微溶 |
实验步骤如下:
将Na2Cr2O7溶液与浓硫酸混合液放置在B中。在A中加入正丁醇和几粒沸石,加热,保持反应温度为90~95℃,在E中收集90℃以上的馏分。
将馏出物倒入分液漏斗中,除去水层,有机层干燥后蒸馏,收集75~77℃馏分。
回答下列问题: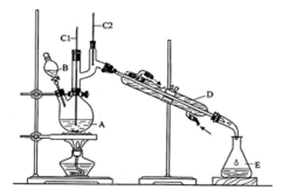
(1)实验中,能否将Na2Cr2O7溶液加到浓硫酸中,说明理由。
(2)上述装置图中,B仪器的名称是,D仪器的名称是。
(3)温度计的作用分别是C1;C2。
(4)将正丁醛粗产品置于分液漏斗中水在层(填“上”或“下”)。
(5)反应温度应保持在90~95℃,其原因是。
某化学兴趣小组设计实验,用浓硫酸与铜反应制得SO2并进行相关实验探究。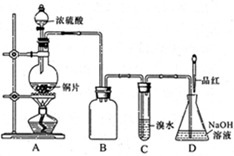
(1)装置A中发生反应的化学方程式
是_______,装置B的作用是_______。
设计装置C的目的是验证SO2的
_______________性,D中NaOH全部转化为
NaHSO3的标志是____________。
(3)反应结束时烧瓶中Cu有剩余,某
同学认为H2SO4也有剩余,他设计了下列实
验方案来测定剩余H2SO4的量。经冷却,定
量稀释后进行下列实验,能达到目的是________(填序号);
a. 用酸碱中和滴定法测定 b. 与足量Zn反应,测量生成H2的体积
c. 用PH计测溶液PH值 d. 与足量BaCl2溶液反应,称量生成沉淀的质量
(4)向D瓶所得NaHSO3溶液中加入漂白粉溶液,反应有三种可能情况:
I. HSO3-与ClO-刚好反应完; II. 漂白粉不足; III. 漂白粉过量
同学们分别取上述混合溶液于试管中,通过下列实验确定该反应属于哪一种情况,请你完成下表:
| 实验序号 |
实验操作 |
现象 |
反应的可能情况 |
| ① |
滴加少量淀粉碘化钾溶液,振荡 |
III |
|
| ② |
滴加少量棕红色的KI3溶液,振荡 |
II |
|
| ③ |
滴入加少量酸性KMNO4溶液,振荡 |
溶液呈紫色 |
|
| ④ |
加入几小块CaCO3固体 |
有气泡产生 |
(15分)某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验。
Ⅰ.(1)试用实验室提供的下列试剂,设计两个原理不同的简单实验(只要写出实验的方案即可),证明镁元素的金属性比铝元素强。
试剂:镁条、铝条、氯化铝溶液、氯化镁溶液、稀盐酸、氢氧化钠溶液
方案一:_____________________________________________________________;
方案二:_____________________________________________________________。
Ⅱ.利用下图装置可验证同周期元素非金属性的变化规律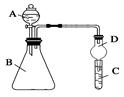
(1)仪器A的名称为________,干燥管D的作用为________________。
(2)若要证明非金属性:Cl>S,则A中加浓盐酸,B中加KMnO4(KMnO4与浓盐酸常温下反应生成氯气),C中加___________,观察到C中溶液___________________________的现象,即可证明。反应的离子方程式为________________________________________________________。
从环境保护的观点考虑,此装置缺少尾气处理装置,可用________溶液吸收尾气。
(3)若要证明非金属性:N>C,则在A中加稀硝酸,B中加碳酸钙,C中加澄清石灰水;观察到C中溶液变浑浊的现象,即可证明。该实验原理为______________________________。但有的同学在实验中一切操作正确的情况下没观察到上述现像,试分析可能的原因是___________________________。