矿泉水一般是由岩石风化后被地下水溶解其中可溶部分生成的。此处所指的风化作用是指矿物与水和CO2同时作用的过程。例如钾长石(KAlSi3O8)风化生成高岭〔Al2Si2O5(OH)4〕,此反应的离子方程式为:2KAlSi3O8+2H2CO3+9H2O=2K++2HCO3-+4H4SiO4+Al2Si2O5(OH)4
这个反应能够发生的原因是______________。
有A、B、C、D、E、F、G、H八种白色固体,它们是:KHSO4、C6H12O6(葡萄糖)、HOOC—COOH、MgCO3、Na2CO3、MgSO4、Al(OH)3、Ba(NO3)2,对这些物质进行实验,结果如下:①各取部分固体分别加入水,除C、F外均能溶解得到澄清溶液;②C(固)+D溶液→固体溶解放出气体,C(固)+H溶液→固体溶解放出气体;③E溶液+H溶液→白色沉淀,E溶液+G溶液→白色沉淀,E溶液+B溶液→白色沉淀;④B溶液+H溶液→放出气体;根据上述实验,判断这八种固体分别是:
A__________________________,B___________________________,C___________________,D__________________________,E____________________________,F___________________,G___________________________,H__________________________。
要进一步证实某固体为葡萄糖,应用___________作试剂,根据_______________现象来确证。
当都市里的人们陶醉在繁华的城市生活中时,是否意识到有一支“大军”正向我们逼近,影响我们的生活,危害我们的健康。
(1)在意大利,人们家里的咖啡壶大多是用回收的可乐罐制得。请再列举一种生活垃圾回收利用的事例:_________________________。
(2)回收利用垃圾,首先要对垃圾进行分类。一群环保志愿者在某社区推广垃圾分类,他们在垃圾房放置了一些有分类标识的垃圾回收箱,结果却发现仍然有许多居民并没有分类放置。造成这种现象可以排除的原因是_________________________。
| A.居民嫌麻烦,没有垃圾分类的习惯 | B.居民每天产生的生活垃圾量多 |
| C.居民的环保意识不强 | D.居民不清楚垃圾分类的标准 |
(3)下图是某居民小区中垃圾收集点(小圆圈)的布局,它在选址上存在的问题有_____________________。垃圾收集点选址应考虑的因素包括________________________。
合成材料的应用与发展,大大方便了人类的生活,但由于合成材料废弃物的急剧增加带来了环境问题,废弃塑料带来的“白色污染”尤为严重。请你就怎样解决“白色污染”提出至少三条切实可行的措施。
(1)_________________________________________________________________________;
(2)_________________________________________________________________________;
(3)_________________________________________________________________________;
(4)_________________________________________________________________________。
人体缺碘会影响正常的生命活动,为提高人体素质,食物补碘已引起人们的重视。试回答下列问题:
(1)成年人体内缺碘会产生的病症是()
A.甲亢B.侏儒症
C.地方性呆小症 D.地方性甲状腺肿
(2)我国缺碘病区甚广,防止缺碘病的主要措施是食盐加碘。1996年我国政府以国家标准的方式规定食盐的碘添加剂是KIO3。不使用KI的原因可能是
A.KI口感苦涩 B.KI有毒
C.KI在储运过程中易变质 D.KI价格昂贵
(3)已知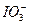 可与I-发生反应:
可与I-发生反应: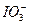 +5I-+6H+====3I2+3H2O,根据此反应,可用试纸和一些生活中常见的物质进行实验,证明在食盐中存在
+5I-+6H+====3I2+3H2O,根据此反应,可用试纸和一些生活中常见的物质进行实验,证明在食盐中存在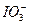 。可供选用的物质有:①自来水;②蓝色石蕊试纸;③碘化钾淀粉试纸;④淀粉;⑤食糖;⑥食醋;⑦白酒。进行上述实验时必须使用的物质是()
。可供选用的物质有:①自来水;②蓝色石蕊试纸;③碘化钾淀粉试纸;④淀粉;⑤食糖;⑥食醋;⑦白酒。进行上述实验时必须使用的物质是()
A.①③ B.③⑥ C.②④⑥ D.①②④⑤⑦
(4)人从食物中摄取碘后,碘便积存在甲状腺内,通过有关化学反应可形成甲状腺素,甲状腺素的合成过程可表示为: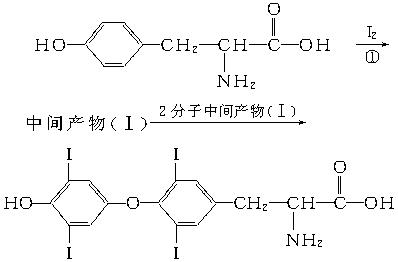
+产物(Ⅱ)
甲状腺素的分子式为_________________,中间产物(Ⅰ)的结构简式为_________________,产物(Ⅱ)的名称为_________________。
环境保护已成为当前和未来的一项全球性重大课题之一。为消除目前燃料使用过程中的环境污染问题,并缓解能源危机,有的专家提供利用太阳能促进燃料循环使用的构想。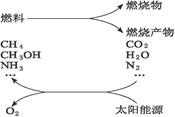
这种构想或方案可用如下反应表示:
①2CO2 2CO+O2
2CO+O2
②H2O _______________
_______________
③N2+H2O _______________
_______________
④CO2+_______________ CH3OH+_______________
CH3OH+_______________
⑤_______________+H2O CH4+_______________
CH4+_______________
(1)请完成上述化学方程式;
(2)要实现上述的一些构想,目前和今后要解决的关键问题是_________________________
______________________________________________________________________________;