为消除碘缺乏病,卫生部规定食盐必须加碘,其中碘以KIO3形式存在。已知溶液中IO-3和I-发生反应:IO-3+5I-+6H+3I2+3H2O,据此反应,可用试纸和一些生活中常见的物质进行试验,证明在食盐中存在IO-3。可供选用的物质有:①自来水、②蓝色石蕊试纸、③碘化钾淀粉试纸、④淀粉、⑤食糖、⑥食醋,进行实验时必须使用的物质有( )
| A.①③ | B.③⑥ |
| C.②④⑥ | D.①②④⑤ |
在一密闭容器中,反应aA(g) 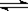 bB (g) 达到平衡后,保持温度不变,将容器体积增加一倍,达到新的平衡时B的浓度是原来的60%,则下列说法不正确的是
bB (g) 达到平衡后,保持温度不变,将容器体积增加一倍,达到新的平衡时B的浓度是原来的60%,则下列说法不正确的是
| A.平衡向正反应方向移动了 | B.物质A的转化率增大了 |
| C.物质B的质量分数增加了 | D.a >b |
对于可逆反应A(g)+2B(g) 2C(g) ΔH﹥0,下列图象中正确的是
2C(g) ΔH﹥0,下列图象中正确的是
恒容密闭容器中进行的可逆反应2NO2  2NO +O2,可作为达到平衡状态的标志是
2NO +O2,可作为达到平衡状态的标志是
①单位时间内生成a mo1 O2的同时生成2a mol NO2 ;
②单位时间内生成a mol O2的同时生成2a molNO;
③混合气体的颜色不再改变;
④混合气体的密度不再改变的状态;
⑤混合气体的平均相对分子质量不再改变的状态。
| A.①②③④⑤ | B.②④⑤ | C.①③④ | D.①③⑤ |
将5.6 g铁粉投入盛有100 mL 2 mol·L-1稀硫酸的烧杯中,2 min 时铁粉刚好溶解完全。如果反应前后溶液的体积不变,则该反应的平均速率可表示为
| A.v(Fe)=0.5 mol·L-1·min-1 | B.v(H2SO4)=1 mol·L-1·min-1 |
| C.v(H2)=1 mol·L-1·min-1 | D.v(FeSO4)=0.5 mol·L-1·min-1 |
铝、铁的混合物溶于足量的盐酸中,再加入过量的NaOH溶液,在空气中静置,当红褐色沉淀不再增加,将沉淀滤出并充分灼烧,得到的固体残留物恰好跟原混合物的质量相等,则此合金中铝的质量分数为
| A.22.2% | B.75.7% |
| C.30.0% | D.80.6% |