有VL稀硝酸、稀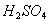 、
、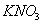 三种物质的混合溶液,已知在该混合液中,
三种物质的混合溶液,已知在该混合液中,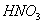 和
和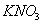 的浓度均为amol/L,而
的浓度均为amol/L,而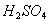 浓度为bmol/L,向该混合液中加入足量的Cu粉,充分反应,放出气体为NO。若反应能进行到底,求出
浓度为bmol/L,向该混合液中加入足量的Cu粉,充分反应,放出气体为NO。若反应能进行到底,求出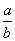 不同的比值范围内,参加反应的Cu的质量。
不同的比值范围内,参加反应的Cu的质量。
将密度为1.84 g / cm3、质量分数为98%的浓硫酸稀释成1 000 mL、物质的量浓度为2 mol /L、密度为1.20 g / cm3的稀硫酸。求:
(1)所需浓硫酸的体积;
(2)所需水的体积。
某种橡胶制品废弃物的分解产物中有多种碳氢化合物,对其中一种碳氢化合物进行以下实验:
①若取一定量的这种碳氢化合物完全燃烧,将燃烧后的气体通过盛有足量CaCl2的干燥管,干燥管质量增重0.675g,再通过足量石灰水,使石灰水质量增重2.2g;
②经测定该碳氢化合物(气体)的密度是相同条件下氢气密度的27倍;
③该碳氢化合物0.1mol能和32g Br2发生加成反应;
④经分析,在③的生成物中溴原子各自分布在不同的碳原子上。
(1)通过计算推断碳氢化合物的分子式?
(2)该碳氢化合物的结构简式为。
定温度下在某定容的密闭容器中发生反应:2A(g) +3B(g) ===2C(g),开始时,A的浓度为2 mol·L -1,B的浓度是4 mol·L-1,2 min后,A的浓度减少0.8 mol·L-1,则
(1)求v(B)和v(C)。
(2)在2min末,C的浓度是多少?B的浓度是多少?
某有机物含有C、H、O三种元素,其蒸气密度是相同条件下CH4密度的3.625倍,把1.16g该有机物在O2中充分燃烧,将生成物通过足量碱石灰,碱石灰增重3.72g,又知生成的CO2和H2O的物质的量之比为1:1。
(1)该有机物的摩尔质量
(2)该有机物的分子式
(3)红外光谱和核磁共振氢谱显示该分子是有一个羟基,无甲基的链状结构,请写出其结构简式。
有机物A由碳、氢、氧三种元素组成。现取3 g A与4.48 L氧气(标准状况)在密闭容器中燃烧,生成二氧化碳、一氧化碳和水蒸气(假设反应物没有剩余)。将反应生成的气体依次通过足量的浓硫酸和碱石灰,浓硫酸增重3.6 g,碱石灰增重4.4 g。回答下列问题:
(1)3 g A中所含氢原子、碳原子的物质的量各是多少?
(2)通过计算确定该有机物的分子式。