下表是食用碘盐包装上的部分说明,下列说法正确的是( )
| A.高温会导致碘的损失 |
| B.碘酸钾可氧化氯化钾 |
| C.可用淀粉检验碘盐中的碘酸钾 |
| D.该碘盐中碘酸钾含量为20~50 mg·kg-1 |
| 配料 |
精盐、碘酸钾、抗结剂 |
| 碘含量 |
35±15 mg·kg-1 |
| 储存方法 |
密封、避光、防潮 |
| 食用方法 |
烹饪时,待食品熟后加入碘盐 |
化学与生活、社会密切相关。下列说法正确的是
| A.光纤通信所使用的光缆的主要成分是晶体Si,太阳能电池使用的常用材料主要是SiO2 |
| B.我国重点城市近年来已发布“空气质量日报”,将CO2、NO2和可吸入颗粒物等列入了首要污染物 |
| C.太阳光透过树叶间的缝隙射入密林中的光柱的形成属于丁达尔效应 |
| D.SO2可以用来漂白纸浆、毛、丝、草帽辫、增白食品等 |
某恒温密闭容器发生可逆反应

 ,在
,在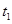 时刻反应达到平衡,在
时刻反应达到平衡,在 时刻缩小容器体积,
时刻缩小容器体积,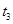 时刻再次达到平衡状态后未再改变条件。下列有关说法中正确的是
时刻再次达到平衡状态后未再改变条件。下列有关说法中正确的是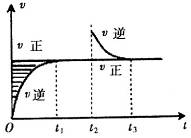
| A.Z和W在该条件下至少有一个是为气态 |
B.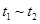 时间段与 时间段与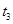 时刻后,两时间段反应体系中气体的平均摩尔质量不可能相等 时刻后,两时间段反应体系中气体的平均摩尔质量不可能相等 |
C.若在该温度下此反应平衡常数表达式为K=c(X),则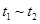 时间段与 时间段与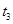 时刻后的X浓度不相等 时刻后的X浓度不相等 |
D.若该反应只在某温度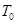 以上自发进行,则该反应的平衡常K随温度升高而增大 以上自发进行,则该反应的平衡常K随温度升高而增大 |
有一未完成的离子方程式:□□+ XO3-+6H+═3X2+3H2O,据此判断X元素的最高化合价为
| A.+7 | B.+6 | C.+5 | D.+1 |
下列说法不正确的是
| A.将pH=4的某酸稀释10倍,测得其pH<5,则该酸为弱酸 |
B.0.1mol 的NaHCO3溶液中 的NaHCO3溶液中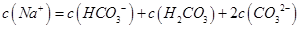 |
C.0.1mol 的NaHA溶液Ph=5,则溶液: 的NaHA溶液Ph=5,则溶液: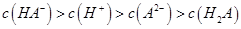 |
D.pH=4的醋酸与pH=10的氢氧化钠溶液等体积混合,所得溶液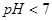 |
下列推断正确的是
| A.CO、NO、NO2都是大气污染的气体,在空气中都能稳定存在 |
| B.Na2O、Na2O2组成元素相同,两化合物中阴阳离子个数比也相同 |
| C.SiO2是酸性氧化物,只能与碱反应而不能与酸反应 |
| D.新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分振荡后溶液呈红 |