根据下图的转化关系完成下列有关问题。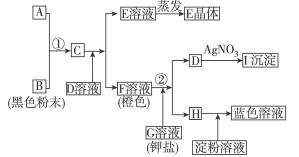
(1)写出①的离子方程式______________________________________;
写出②的离子方程式________________________________________。
(2)写出下列物质或溶液中溶质的化学式。
E_______________________________________,I____________________________________。
(3)在上述转化过程中,判断B、C、F、H氧化能力由弱到强的顺序(写化学式):
_______________________________________________________________________________。
硫酸、硝酸和盐酸既是重要的化工原料也是化学实验室里必备的试剂。
(1)常温下,可用铝槽车装运浓硫酸,这是因为浓硫酸具有性;硝酸应保存在棕色试剂瓶中,这是因为硝酸具有性;敞口放置的浓盐酸浓度会减小,这是因为盐酸具有性。
(2)①在100 mL 18 mol·L-1的浓硫酸中加入过量的铜片,加热使之充分反应,产生的气体在标准状况下的体积为13.44 L,则参加反应的铜片的质量为(选填序号);
a.115.2 g b.76.8 g c.57.6 g d.38.4 g
②若使上述①中反应剩余的铜片继续溶解,可向其中加入硝酸钠,写出反应的离子方程式:。
(3)工业制盐酸是以电解饱和氯化钠溶液为基础进行的,该电解过程中阳极的电极反应式为:。
铁和铝是生产和生活中最常见的两种金属,其单质和化合物被广泛应用。
(1)硫酸铁溶液可用于浸出黄铜矿精矿,其主要反应为:
CuFeS2+4Fe3+=Cu2++5Fe2++2S(CuFeS2中S为-2价,Fe为+2价)。
关于该反应,下列说法中,正确的是(选填序号);
a.从物质分类的角度看,CuFeS2属于合金 b.反应过程中只有一种元素被还原
c.CuFeS2既作氧化剂又作还原剂 d.当转移1 mol电子时,产生16 g S
(2)高铁酸钾(K2FeO4)是一种新型水处理剂,在水中发生反应生成Fe(OH)3胶体。该反应中,高铁酸钾表现(填“氧化性”或“还原性”),Fe(OH)3胶体具有净水作用,其原因是。
(3)某同学取一张铝箔,并用针刺一些小孔,然后取一药匙过氧化钠粉末,用铝箔包好,放入右图所示装置内倒扣的漏斗中(图中铁架台和铁夹没有画出)。
按顺序写出该过程中发生反应的离子方程式:
①;
②。
化合物G是合成抗癌药物美法伦的中间体,它的结构简式为: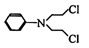
它可由中学常见的简单有机物为主要原料合成,其合成线路如下: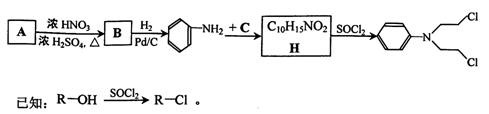
(1)D与A组成的元素相同,原子个数比也相同,按要求写出符合条件的D的结构简式:
①分子的空间构型为直线型的分子;
②分子中所有的碳原子均为sp3杂化的分子;
③NMR图谱中有5个峰,波峰面积之比为2:1:2:2:1的分子;
(2)B的一氯代物有三种同分异构体,B与足量氢气在一定条件下反应生成饱和有机物Y,则Y环上的一氯代物的同分异构体有种;
(3)已知氨气与醇在一定条件下能发生分子间的脱水反应。请写出氨气与物质C以物质的量之比为1:3反应生成的产物的结构简式,该有机物中含有的官能团的名称是,
(4)写出在加热且有浓硫酸存在条件下,H与乙二酸以物质的量比为1:1反应的化学方程式,
该反应的类型是。
(5)化合物H的一种同分异构体X,能与氯化铁溶液发生显色反应,且能与浓溴水反应,1 mol X最多消耗3 mol Br2,写出X的结构简式。(要求写出两种)
I.氢能的存储是氢能应用的主要瓶颈,配位氢化物、富氢载体化合韧是目前所采用的主要储氢材料。
(1)Ti(BH4)2是一种过渡元素硼氢化物储氢材料。在基态Ti2+中,电子占据的最高能层符号为,该能层具有的原子轨道数为;
(2)液氨是富氢物质,是氢能的理想载体,利用 实现储氢和输氢。下列说法正确的是;
实现储氢和输氢。下列说法正确的是;
a.NH3分子中氮原子的轨道杂化方式为sp2杂化
b.NH+4与PH+4、CH4、BH-4、ClO—4互为等电子体
c.相同压强时,NH3的沸点比PH3的沸点高
d.[Cu(NH3)4]2+离子中,N原子是配位原子
(3)已知NF3与NH3的空间构型相同,但NF3不易与Cu2+形成配离子,其原因是;
II.氯化钠是生活中的常用调味品,也是结构化学中研究离子晶体时常用的代表物,其晶胞结构如图所示。
(1)设氯化钠晶体中Na+与跟它最近邻的Cl—之间的距离为r,则该Na+与跟它次近邻的C1—个数为,该Na+与跟它次近邻的Cl—之间的距离为;
(2)已知在氯化钠晶体中Na+的半径为以a pm,Cl—的半径为b pm,它们在晶
体中是紧密接触的,则在氯化钠晶体中离子的空间利用率为;(用含a、b的式子袁示)
(3)纳米材料的表面原子占总原子数的比例很大,这是它有许多特殊性质的原因。假设某氯化钠颗粒形状为立方体,边长为氯化钠晶胞的10倍,则该氯化钠颗粒中表面原子占总原子数的百分比为。
世界环保联盟建议全面禁止使用氯气用于饮用水的消毒,而建议采用高效“绿色”消毒剂二氧化氯。二氧化氯是一种极易爆炸的强氧化性气体,易溶于水、不稳定、呈黄绿色,在生产和使用时必须尽量用稀有气体进行稀释,同时需要避免光照、震动或受热。实验室以电解法制备ClO2的流程如下: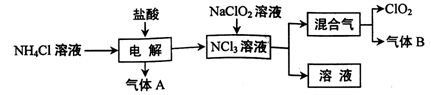
(1)ClO2中所有原子(填“是”或“不是”)都满足8电子结构。上图所示方法制得的混合气中杂质气体B能使石蕊试液显蓝色,除去该杂质气体可选用__;
A.饱和食盐水B.碱石灰C.浓硫酸D.蒸馏水
(2)稳定性二氧化氯是为推广二氧化氯而开发的新型产品。下列说法正确的是;
A.二氧化氯可广泛用于工业和饮用水处理
B.应用在食品工业中能有效地延长食品贮藏期
C.稳定性二氧化氯的出现大大增加了二氧化氯的使用范围
D.在工作区和成品储藏室内,要有通风装置和监测及警报装置
(3)欧洲国家主要采用氯酸钠氧化浓盐酸制备,但该方法缺点是产率低、产品难以分离,还可能污染环境。写出该方法发生的化学方程式;
(4)我国广泛采用经干燥空气稀释的氯气与固体亚氯酸钠(NaClO2)反应制备,化学方程式是
,此法相比欧洲方法的优点是
(5)科学家又研究出了一种新的制备方法,利用硫酸酸化的草酸(H2C2O4)溶液还原氯酸钠,化学反应方程式为,此法提高了生产及储存、运输的安全性,原因是____。