在强酸性条件下,下列离子能大量共存的是( )
| A.Na+、I-、Cl-、ClO- | B.Ca2+、Na+、 、Cl- 、Cl- |
| C.K+、Ba2+、Cl-、I- | D.K+、Na+、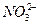 、 、 |
某单烯烃与H2加成后的产物是 则该烯烃的结构式可能有多少种
则该烯烃的结构式可能有多少种
| A.1 | B.2 | C.3 | D.4 |
下列反应中,属于加成反应的是
| A.甲烷与氯气反应制取一氯甲烷 | B.乙酸与乙醇反应制取乙酸乙酯 |
| C.苯酚与饱和溴水反应生成三溴苯酚 | D.乙烯与氯化氢反应制取氯乙烷 |
在乙醇发生的各种反应中,断键方式不正确的是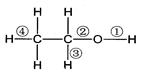
| A.与金属钠反应时,键①断裂 | B.与醋酸、浓硫酸共热时,键②断裂 |
| C.与浓硫酸共热至170℃时,键②和④断裂 | D.与HCl反应生成氯乙烷时,键②断裂 |
下列物质沸点的比较,正确的是
| A.乙烷 > 丙烷 | B.正戊烷 > 异戊烷 |
| C.丙烷 > 乙醇 | D.乙醇 > 乙二醇 |
下列有机物的系统命名中正确的是
| A.3-甲基-4-乙基戊烷 | B.3,3,4-三甲基己烷 |
| C.3,4,4-三甲基己烷 | D.3,5-二甲基己烷 |