向5 mL NaCl溶液中滴入一滴AgNO3溶液,出现白色沉淀,继续滴加一滴KI溶液,沉淀变为黄色,再滴入一滴硫化钠溶液,沉淀又变为黑色。根据上述变化过程,分析此三种沉淀物的溶解程度关系为()
| A.AgCl=AgI=Ag2S | B.AgCl<AgI<Ag2S |
| C.AgCl>AgI>Ag2S | D.AgI>AgCl+Ag2S |
下图是工业电解饱和食盐水的装置示意图,下列说法中不正确的是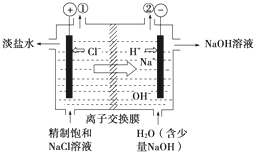
| A.装置出口①处的物质是氯气, |
| B.出口②处的物质是氢气,该离子交换膜只能让阳离子通过, |
C.装置中发生的反应的离子方程式2Cl-+2H+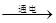 Cl2↑+H2↑ Cl2↑+H2↑ |
| D.该装置是将电能转化为化学能 |
下列各组热化学方程式中,△H1>△H2的是
①C(s)+O2(g)===CO2(g) △H1 C(s)+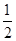 O2(g)===CO(g) △H2
O2(g)===CO(g) △H2
②S(s)+O2(g)===SO2(g) △H1S(g)+O2(g)===SO2(g) △H2
③H2(g)+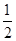 O2(g)===H2O(l) △H1 2H2(g)+O2(g)===2H2O(l) △H2
O2(g)===H2O(l) △H1 2H2(g)+O2(g)===2H2O(l) △H2
④CaCO3(s)===CaO(s)+CO2(g) △H1 CaO(s)+H2O(l)===Ca(OH)2(s) △H2
| A.① | B.②③④ | C.④ | D.①②③ |
在常温下,1 mol化学键分解成气态原子所需要的能量用E表示。结合表中信息判断下列说法不正确的是
| 共价键 |
H-H |
F-F |
H-F |
H-Cl |
H-I |
| E(kJ·mol -1 ) |
436 |
157 |
568 |
432 |
298 |
A.432 kJ/mol >E(H-Br)>298 kJ/mol
B.表中最稳定的共价键是H—F键
C.H2(g)+F2(g)=2HF(g) △H=—25 kJ/mol
D.H 2(g)→2H(g) △H=+436 kJ/mol
下列有关能量转换的说法正确的是
| A.风力发电是化学能转换为电能 |
| B.动物体内的葡萄糖被氧化成CO2,是热能转换成化学能 |
| C.植物通过光合作用将CO2转化为葡萄糖,是将太阳能转换成热能 |
| D.植物燃烧时放出的能量来源于太阳能 |
已知反应:①2C(s)+O2(g)=2CO(g) ΔH=-221 kJ/mol;②稀溶液中,H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ/mol。下列结论正确的是
| A.碳的燃烧热110.5 kJ/mol |
| B.①的反应热为221 kJ/mol |
| C.稀醋酸与稀NaOH溶液反应的中和热为57.3 kJ/mol |
| D.稀盐酸与稀NaOH溶液反应的中和热为57.3 kJ/mol |