莫尔盐[(NH4)2Fe(SO4)2·6H2O]常作氧化还原滴定法的基准物质,在0.1mol/L的该盐的溶液中,下列有关比较不正确的是( )
A.c(SO )> c(NH )> c(NH )>c(Fe2+)>c(H+)>c(OH-) )>c(Fe2+)>c(H+)>c(OH-) |
B.c(NH3·H2O)+c(NH )= 0.2mol/L )= 0.2mol/L |
| C.c(H+)= c(OH-)+c(NH3·H2O) |
D.2 c(SO )+ c(OH-)= c(NH )+ c(OH-)= c(NH )+2 c(Fe2+)+c(H+) )+2 c(Fe2+)+c(H+) |
室温下,将1mol的CuSO4·5H2O(s)溶于水会使溶液温度降低,热效应为ΔH1;将1mol的CuSO4(s)溶于水会使溶液温度升高,热效应为ΔH2;CuSO4·5H2O受热分解的化学方程式为:CuSO4·5H2O(s) CuSO4(s) +5H2O(
CuSO4(s) +5H2O(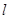 ),热效应为ΔH3。则下列判断正确的是
),热效应为ΔH3。则下列判断正确的是
| A.ΔH2>ΔH3 | B.ΔH1<ΔH3 |
| C.ΔH1+ΔH3=ΔH2 | D.ΔH1+ΔH2=ΔH3 |
有一种燃料电池,所用燃料为H2和空气,电解质为熔融的K2CO3。电池的总反应式为2H2+O2===2H2O,负极反应为H2+CO32--2e-===H2O+CO2。该电池放电时,下列说法中正确的是
| A.正极反应为2H2O+O2+4e-===4OH- |
| B.CO32-向负极移动 |
| C.电子由正极经外电路流向负极 |
| D.电池中CO32-的物质的量将逐渐减少 |
根据碘与氢气反应的热化学方程式
(i) I2(g)+ H2(g)  2HI(g)△H="-9.48" kJ/mol
2HI(g)△H="-9.48" kJ/mol
(ii) I2(s)+H2(g) 2HI(g)△H="+26.48" kJ/mol
2HI(g)△H="+26.48" kJ/mol
下列判断正确的是
| A.254g I2(g)中通入2g H2(g),反应放热9.48 kJ |
| B.反应(ii)的反应物总能量比反应(i)的反应物总能量低 |
| C.反应(i)的产物比反应(ii)的产物稳定 |
| D.1 mol固态碘与1 mol气态碘所含的能量相差17.00 kJ |
2013年3月我国科学家报道了如图所示的水溶液锂离子电池体系。下列叙述不正确的是
| A.a为电池的正极 |
| B.电池充电反应为LiMn2O4=Li1-xMn2O4+xLi |
| C.放电时,a极锂的化合价发生变化 |
| D.放电时,溶液中的Li+从b向a迁移 |
下列说法正确的是
①离子化合物一定含离子键,也可能含极性键或非极性键
②共价化合物一定含共价键,也可能含离子键
③含金属元素的化合物不一定是离子化合物
④由非金属元素组成的化合物一定是共价化合物
⑤由分子组成的物质中一定存在共价键
⑥熔融状态能导电的化合物一定是离子化合物
| A.①③⑤ | B.②④⑥ | C.②③④ | D.①③⑥ |