下列电离方程式或离子方程式正确的是( )
A.NaHCO3电离:NaHCO3====Na++H++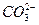 |
B.H3PO4电离:H3PO4====3H++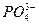 |
C.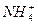 水解: 水解: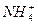 +H2O +H2O NH3·H2O+H+ NH3·H2O+H+ |
D.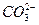 水解: 水解: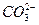 +H2O +H2O H2CO3+2OH- H2CO3+2OH- |
已知:AgI为黄色沉淀,AgCl为白色沉淀。25℃时,AgI饱和溶液中c(Ag+)为1.22×10-8 mol·L-1;AgCI饱和溶液中c(Ag+)为1.30×10-5mol·L-1。若在5 mL含有KC1和KI浓度均为0.01 mol·L-1的混合溶液中,滴加8 mL0.0l mol·L-1的AgNO3溶液,则下列叙述中不正确的是
| A.溶液中所含溶质的离子浓度大小关系为c(K+)>c(NO3-)>c(Cl-)>c(I-)>c(Ag+) |
| B.溶液中先产生的是AgI沉淀 |
| C.AgCl的KSP的数值为1.69×10-10 |
| D.若在AgI悬浊液中滴加一定量的KCl溶液,黄色沉淀也会转变成白色沉淀 |
下列有关实验的叙述中,合理的是
| A.把SO2通入紫色石蕊试液,可验证SO2的漂白性 |
B.构成如图所示装置时,盐桥中的K+向左池移动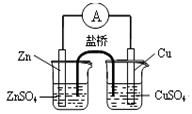 |
| C.配制一定物质的量浓度的溶液,定容时俯视容量瓶的刻度线,会使所配溶液浓度偏高 |
| D.将l0 克 ZnSO4·7H2O溶解在90克水中配制10%的ZnSO4溶液 |
下列各溶液中,叙述正确的是
| A.0.1mol/L的(NH4)2SO4溶液中:c(SO42-)>c(NH4+)>c(H+)>c(OH-) |
| B.25℃时,将pH=3的盐酸溶液和pH=11的氨水等体积混合后,溶液中离子浓度的大小关系:c(Cl-)>c(NH4+)>c(OH-)>c(H+) |
| C.将0.1mol/L醋酸溶液加大量水稀释后,溶液的pH增大 |
| D.Na2CO3溶液中:c(Na+ )="2c" (CO32- ) + c (HCO3- ) + c (H2CO3 ) |
下列变化不能用勒夏特列原理解释的是
| A.新制氯水久置后,颜色变浅 |
| B.H2、I2、HI混合气体加压后,颜色变深 |
| C.合成氨时将氨液化分离,可提高原料的利用率 |
| D.向H2S水溶液中加入NaOH,有利于S2-增多 |
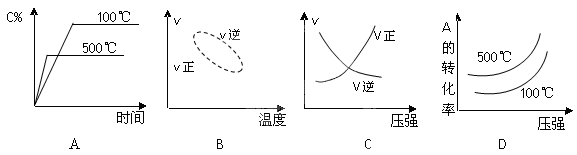
用来表示可逆反应2A(g) + B(g) 2C(g) ;△H<0的正确图像为
2C(g) ;△H<0的正确图像为