下列离子组中因相互促进水解而不能共存的离子组是( )
A.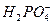 、Na+、Cl-、OH- 、Na+、Cl-、OH- |
B.Al3+、Na+、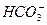 、 、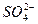 |
C.H+、Fe2+、 、 、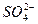 |
D.Na+、 、 、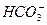 、Cl- 、Cl- |
下列事实中,不能用勒夏特列原理解释的是()
| A.NO2、N2O4平衡混合气体加热后颜色变深 |
| B.氯水长期露置于空气中褪色 |
| C.弱电解质的溶液达到平衡后,加水稀释,平衡向电离的方向移动 |
| D.合成氨工业,采用铁触媒催化剂 |
关于有效碰撞理论,下列说法正确的是()
| A.活化分子间所发生的所有碰撞为有效碰撞 |
| B.增大反应物浓度能够增大活化分子百分数,化学反应速率一定增大 |
| C.升高温度,活化分子百分数增加,化学反应速率一定增大 |
| D.增大压强,活化分子数一定增加,化学反应速率一定增大 |
下列各表述与示意图一致的是 ( )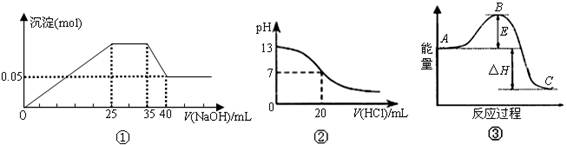
| A.图①表示向含Mg2+、Al3+、NH4+的盐溶液中滴加NaOH溶液时,沉淀的量与NaOH的体积的关系图。则三种离子的物质的量之比为:n(Mg2+)∶n(Al3+):n( NH4+)=2∶3∶2 |
| B.图①中使用的NaOH的浓度为2 mol/L |
| C.图②表示25℃时,用0.1 mol·L-1盐酸滴定20 mL 0.1 mol·L-1 NaOH溶液,溶液的pH随加入酸体积的变化 |
D.图③中曲线表示3N2(g)+N2(g) 2NH3(g)反应过程的能量变化。若使用催化剂,B点会升高 2NH3(g)反应过程的能量变化。若使用催化剂,B点会升高 |
类比(比较)是研究物质性质的常用方法之一,可预测许多物质的性质。但类比是相对的,不能违背客观实际。下列各说法中,正确的是()
| A.CH4是正四面体结构,SiH4也是正四面体结构 |
| B.NaOH是强电解质,饱和溶液导电能力很强;Ca(OH)2也是强电解质,其饱和溶液导电能力也很强 |
| C.IVA族元素氢化物沸点顺序是:GeH4 > SiH4 > CH4;则VA族元素氢化物沸点顺序也是:AsH3 > PH3 > NH3 |
| D.CaCO3与稀硝酸反应生成CO2,CaSO3与稀硝酸反应生成SO2 |
锑(Sb)在自然界一般以硫化物的形式存在,我国锑的蕴藏量占世界第一。从硫化物中提取单质锑一般是先在高温下将硫化物转化为氧化物,再用碳还原:
2Sb2S3 + 3O2 + 6Fe = Sb4O6 + 6FeS ①
Sb4O6 + 6C =" 4Sb" + 6CO ②
关于反应①、②的说法正确的是()
| A.反应①②中的氧化剂分别是Sb2S3、Sb4O6 |
| B.反应①中每生成3 mol FeS时,共转移6 mol电子 |
| C.反应②说明高温下Sb的还原性比C强 |
| D.每生成4 mol Sb时,反应①与反应②中还原剂的物质的量之比为4∶3 |