在常温下10mLpH=10的KOH溶液中,加入pH=4的一元酸HA溶液至pH刚好等于7(假设反应前后体积不变),则对反应后溶液的叙述正确的是()
| A.c(A-)=c(K+) |
| B.c(H+)=c(OH-)<c(K+)<c(A-) |
C.V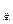 ≥20mL ≥20mL |
D.V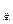 ≤20mL ≤20mL |
根据下图海水综合利用的工业流程图,判断下列说法正确的是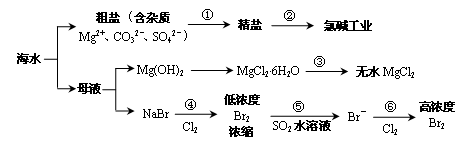
已知:MgCl2·6H2O受热生成Mg(OH)Cl和HCl气体等。
| A.过程①的提纯是物理过程,过程②通过氧化还原反应可产生2种单质 |
| B.在过程③中将MgCl2·6H2O灼烧即可制得无水MgCl2 |
| C.在过程④、⑥反应中每氧化0.2 mol Br- 需消耗2.24 L Cl2 |
| D.过程⑤反应后溶液呈强酸性,生产中需解决其对设备的腐蚀问题 |
下列制备和收集气体的实验装置合理的是
A.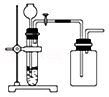 用锌粒和稀硫酸制H2 用锌粒和稀硫酸制H2 |
B.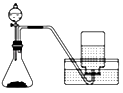 用H2O2和MnO2制O2 用H2O2和MnO2制O2 |
C.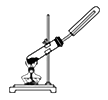 用氯化铵和氢氧化钙固体制NH3 用氯化铵和氢氧化钙固体制NH3 |
D.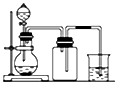 用铜片和稀硝酸制NO 用铜片和稀硝酸制NO |
下列有关NaHSO3溶液的叙述正确的是
| A.该溶液中,K+、Ca2+、Cl2、Br—可以大量共存 |
| B.能使含I2的淀粉溶液蓝色褪去,说明NaHSO3溶液具漂白性 |
| C.与FeCl3反应的离子方程式:SO32—+2Fe3++H2O = SO42—+2Fe2++ 2H+ |
| D.和足量Ca(OH)2溶液反应的离子方程式:Ca2++OH—+ HSO3—= CaSO3↓+H2O |
阿伏加德罗常数用NA表示,下列说法中正确的是
| A.1 mol CH3+(碳正离子)中含有质子数为8NA |
| B.标准状况下,22.4 L溴单质所含原子数目为2NA |
| C.常温下,100mL lmol.L﹣l盐酸与4.6 g钠反应生成H2分子数目为0.1 NA |
| D.密闭容器盛有0.1 mol N2和0.3 mol H2在一定条件下充分反应,转移电子的数目为0.6 NA |
下列叙述Ⅰ和Ⅱ均正确并且有因果关系的是
| 选项 |
叙述Ⅰ |
叙述Ⅱ |
| A |
Fe3+有氧化性 |
Fe 2(SO4)3可作净水剂 |
| B |
浓硫酸有腐蚀性 |
常温下浓硫酸不能用铁罐盛装 |
| C |
Cl2是非金属单质 |
Cl2能使湿润的有色布条褪色 |
| D |
熔融状态的NaCl中有自由移动的Na+和Cl- |
电解熔融状态的NaCl制备Na |