某同学想把AlCl3溶液和Na2S溶液混合制取Al2S3,但最后得到一种白色絮状沉淀,并且混合液中有臭鸡蛋气味的气体放出。试解释造成此结果的原因,写出反应的离子方程式,并指出制取硫化铝的正确方法。
X、Y、Z、W、L、M六种短周期主族元素的原子序数依次增大,其中X、M的单质在常温下呈气态,Y的原子最外层电子数是其电子层数的2倍,Z在同周期的主族元素中原子半径最大,W是地壳中含量最多的金属元素,L的单质晶体熔点高、硬度大,是一种重要的半导体材料。用化学用语回答下列问题:
(1)M在元素周期表中的位置为。
(2)Y、L、M的最高价含氧酸的酸性由弱到强的顺序是(写化学式)。
(3)原子序数比Y多2的元素的一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是。
(4)写出Z的最高价氧化物对应的水化物与单质W反应的离子方程式为
。
(5)R与Y同周期,R的单质分子R2中有3个共价键,R与L能形成一种新型无机非金属材料,其化学式是。
(6)碘是人体必需的微量元素之一,有“智力元素”之称。我国从1989年开始,逐步以KIO3取代KI加工碘盐。已知在酸性溶液中可发生反应: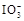 +5I-+6H+=3I2+3H2O,据此反应,可用试纸和一些生活中常见的物质设计实验,证明食盐中存在
+5I-+6H+=3I2+3H2O,据此反应,可用试纸和一些生活中常见的物质设计实验,证明食盐中存在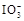 。可供选用的物质有:①自来水;②蓝色石蕊试纸;③碘化钾淀粉试纸;④淀粉;⑤食醋;⑥白酒;⑦食糖。你认为进行上述实验时必须使用的物质是(填序号)。
。可供选用的物质有:①自来水;②蓝色石蕊试纸;③碘化钾淀粉试纸;④淀粉;⑤食醋;⑥白酒;⑦食糖。你认为进行上述实验时必须使用的物质是(填序号)。
I、关于As的反应中,反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X。
①已知KBrO3在反应中得到电子,则该反应的还原剂是。
②已知0.2molKBrO3在反应中得到1mol电子生成X,则X的化学式为。
③根据上述反应可推知。(填序号)
| A.氧化性:KBrO3>H3AsO4 | B.氧化性:H3AsO4>KBrO3 |
| C.还原性:AsH3>X | D.还原性:X>AsH3 |
④在该反应中,氧化剂与还原剂的物质的量之比为。
原子序数之和为16的三种短周期元素x、y、z对应的单质X、Y、Z,常温常压下均为无色气体,在适当条件下单质X、Y、Z之间可以发生如下图所示的变化。已知B分子组成中z原子个数比C分子中少一个。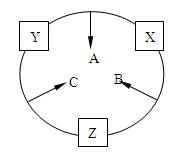
请回答下列问题:
(1)单质Y的结构式为。
(2)C与X在一定条件下生成化合物A的化学方程式:。
(3)常温下,C的水溶液能够使红色石蕊试纸变蓝,请用离子方程式表示变蓝的原因:
。
(4)写出A与C反应生成Y和B的化学方程式。
(5)用电子式表示B的形成过程。
在工业生产中,X的产量是衡量一个国家石油化工水平发展的标志;G是合成高分子化合物,用于制备塑料。现有如下的反应关系:(部分反应条件和产物已省去)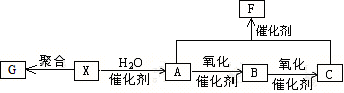
(1)X的结构简式为; A的结构式为。
(2)B中含有的官能团的名称为;X→A的反应类型为。
(3)写出下列转化的化学方程式:X→G ;
A+C→F 。
工业上常用法冶炼铝。铝粉和氧化铁粉末的混合物在高温下的反应被称为反应,设计一个简单实验方案证明上述反应所得的块状融熔物中含有金属铝,该实验所用的试剂是,反应的离子方程式为:。