已知在Na2HPO4溶于水后,它的水解程度远大于电离程度。对于平衡: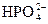 +H2O
+H2O H3O++
H3O++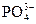 ,欲使溶液中c(
,欲使溶液中c(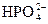 )、c(H3O+)、c(
)、c(H3O+)、c(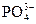 )均下降,可采用的方法是()
)均下降,可采用的方法是()
| A.加少量水 | B.加热 |
| C.加消石灰 | D.加AgNO3 |
某学生做实验后,采用下列方法清洗所有仪器:①用稀HNO3清洗做过银镜反应的试管②用酒精清洗做过碘升华的烧杯③用盐酸清洗长期盛放FeCl3溶液的试剂瓶④用盐酸溶液清洗盛过苯酚的试管。你认为他的操作
| A.②不对 | B.③不对 | C.④不对 | D.全部正确 |
下列关于醇和酚的说法中,正确的是
| A.含有羟基的化合物一定是醇 |
| B.分子内有苯环和羟基的化合物一定是酚 |
| C.羟基跟链烃基相连时,有机物为醇 |
| D.酚和醇具有相同的官能团,因而具有相同的化学性质 |
下列有机物中,能发生消去反应生成2种烯烃,又能发生水解反应的是
| A.1-溴丁烷 | B.2-甲基-3-氯戊烷 |
| C.2,2-二甲基-1-氯丁烷 | D.1,3-二氯苯 |
维生素C(VitaminC)又名抗坏血酸,具有酸性和强还原性,也是一种常见的食品添加剂,其结构如图。下列有关说法中正确的是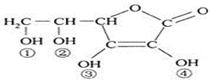
A.维生素C的分子式为C6H10O6
B.维生素C的酸性可能是③、④两个羟基引起的
C.维生素C由于含有C=O键而能发生银镜反应
D.维生素C由于含有酯基而难溶于水
已知胰岛素含硫的质量分数为3.4%,相对分子质量为5734,则每个胰岛素分子中所含的硫原子数为
| A.2 | B.4 | C.6 | D.8 |