常温下pH=2的一元弱酸HA溶液,其电离百分率为5%,0.01mol·L-1的一元碱BOH溶液中,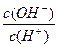 =1×1010。将上述两种溶液等体积混合后,得到溶液中各离子浓度大小关系正确的是()
=1×1010。将上述两种溶液等体积混合后,得到溶液中各离子浓度大小关系正确的是()
| A.c(OH-)>c(H+)>c(B+)>c(A-) | B.c(B+)=c(A-)>c(H+)>c(OH-) |
| C.c(B+)>c(A-)>c(H+)>c(OH-) | D.c(A-)>c(B+)>c(H+)>c(OH-) |
下图是用未知浓度的NaOH溶液来滴定10mL盐酸(标准液)所得的曲线(25℃),则下列说法不正确的是
| A.标准液盐酸的浓度为0.1 mol/L |
| B.NaOH溶液的浓度为0.05 mol/L |
| C.滴定终点时,俯视碱式滴定管读数,所测NaOH溶液浓度会偏高 |
| D.指示剂变色时,说明盐酸与NaOH恰好完全反应 |
在相同温度时,100mL 0.01mol·L-1的醋酸溶液与10mL 0.1mol·L-1的醋酸溶液相比较,下列数值中,前者大于后者的是
| A.H+的物质的量 | B.醋酸的电离常数 |
| C.中和时所需NaOH的量 | D.CH3COOH的物质的量 |
由硫酸钾、硫酸铝和硫酸组成的混合溶液,其pH=1,c(Al3+)=0.4mol·L-1,c(SO42-)=0.8mol·L-1,则c(K+)为
| A.0.15 mol·L-1 | B.0.2 mol·L-1 |
| C.0.3 mol·L-1 | D.0.4 mol·L-1 |
下图表示2A(g)+B(g) 2C(g) ΔH<0,这个反应的正确图像为
2C(g) ΔH<0,这个反应的正确图像为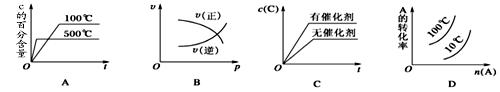
25℃时,下列叙述中,正确的是
| A.CH3COONa溶液中:c(Na+) = c(CH3COO-) |
| B.pH=3的醋酸溶液加水稀释过程中:溶液中各离子浓度均变小 |
| C.pH相同的NaOH溶液与NaHCO3溶液中:水的电离程度相同 |
| D.pH=9的NaHX溶液中: c(H2X)>c(X2-) |