
(1)反应达到平衡时,放出的热量 。
A.小于92.2 kJ B.等于92.2 kJ C.大于92.2 kJ
(2)保持同一温度,在相同的容器中,若起始时加入2 mol NH3、1mol H2及固体催化剂,反应达到平衡时NH3的体积分数 。
A.等于0.25 B.大于0.25 C.小于0.25
(3)保持同一温度,在相同的容器中,起始通入一定物质的量N2、H2、NH3,欲使平衡时NH3的体积分数一定等于0.25。且起始时向正反应方向进行,
则充入N2的物质的量a(mol)的取值范围是 。
(4)右图是Tl℃时容器中NH3的物质的量随时间的变化曲线,
请在该图中补画出该反应在T2℃(T2>T1)时n(NH3)的变化
曲线。
对室温下pH相同、体积相同的醋酸和硫酸两种溶液分别采取下列措施,有关叙述正确的 是
是
| A.加适量的醋酸钠晶体后,两溶液的pH均增大 |
| B.使温度都升高20℃后,两溶液的pH均不变 |
| C.加水稀释2倍后,两溶液的pH均减小 |
| D.两溶液完全中和时消耗NaOH的量相同 |
已知NaHSO4在水中的电离方程式为:NaHSO 4==Na++H++SO
4==Na++H++SO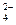 。某温度下,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH为2。下列对该溶液的叙述中,不正确的是
。某温度下,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH为2。下列对该溶液的叙述中,不正确的是
| A.该温度高于25℃ |
| B.由水电离出来的H+的浓度是1.0×10-12mol·L-1 |
| C.加入NaHSO4晶体抑制了水的电离 |
| D.该温度下加入等体积pH为12的NaOH溶液可使该溶液性呈碱性 |
通过分别加入AgNO3、Ba(NO3)2、Mg(NO3)2三种试剂,使某溶液中的Cl-、OH-、CO32-先后沉淀出来,逐一加以分离,则加入三种试剂的顺序是
| A.AgNO3、Ba(NO3)2、Mg(NO3)2 | B.Mg(NO3)2、Ba(NO3)2、AgNO3 |
| C.Ba(NO3)2、AgNO3、Mg(NO3)2 | D.Ba(NO3)2、Mg(NO3)2、AgNO3 |
下列表示水解的离子方程式正确的是
A.CH3COO— + H2O CH3COOH + OH— CH3COOH + OH— |
B.NH4+ + H2O N N H4OH + H+ H4OH + H+ |
C.S2-+2H2O H2S+2 OH— H2S+2 OH— |
D.HCO3-+H2O  H3O++CO32- H3O++CO32- |
下列生产、生活等实际应用,不能用勒夏特列原理解释的是
A.溴水中有下列平衡Br2+H2O HBr + HBrO,当加入AgNO3溶液后溶液颜色变浅 HBr + HBrO,当加入AgNO3溶液后溶液颜色变浅 |
| B.合成氨工业中使用铁触媒做催化剂 |
| C.合成NH3反应,为提高NH3的产率,理论上应采取低温度的措施 |
D.对2HI(g) H2(g)+I2(g),保持容器体积不变,通入氢气可使平衡体系颜色变浅 H2(g)+I2(g),保持容器体积不变,通入氢气可使平衡体系颜色变浅 |