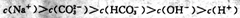将硫化氢通入不同浓度的硝酸溶液中,发生下列反应:
①3H2S+2HNO3 3S↓+2NO↑+4H2O
3S↓+2NO↑+4H2O
②H2S+2HNO3 S↓+2NO2↑+2H2O
S↓+2NO2↑+2H2O
③4H2S+2HNO3 4S↓+NH4NO3+3H2O
4S↓+NH4NO3+3H2O
④5H2S+2HNO3====5S↓+N2↑+6H2O
结合所学有关硝酸的知识,判断硝酸浓度由大到小的顺序是( )
| A.①>②>③>④ | B.②>①>④>③ |
| C.②>①>③>④ | D.④>③>①>② |
下列各组离子一定能大量共存的是 ( )
| A.在含大量Fe3+的溶液中:NH、Na+、Cl-、SCN- |
| B.在强碱性溶液中:Na+、K+、AlO、CO |
| C.在c(H+)=10-13 mol/L的溶液中:NH、Al3+、SO、NO |
| D.在pH=1的溶液中:K+、Fe2+、Cl-、NO |
下列四个图像的有关描述正确的是
注:E:表示能量,p1>p2表示压强,t表示时间,V表示体积,B%表示B的体积百分含量。
A.图①表示化学反应 的能量变化,该反应的
的能量变化,该反应的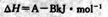
B 图②表示其它条件不变时,反应 在不同压强下随时间的变化
在不同压强下随时间的变化
C.图③表示体积和浓度均相同的HCl和 两种溶液中,分别加人足量的锌,产生H2的体积随时间的变化,则a表示
两种溶液中,分别加人足量的锌,产生H2的体积随时间的变化,则a表示 溶液
溶液
D.图④表示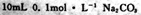 和
和 两种溶液中,分别逐滴滴加
两种溶液中,分别逐滴滴加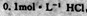 ,产生CO2的体积随盐酸体积的变化,则b表示
,产生CO2的体积随盐酸体积的变化,则b表示 溶液
溶液
某同学用下图装置测定水中氢、氧元素的质量比,实验测得 .下列对导致这_结果的原因分折中,一定错误的是
.下列对导致这_结果的原因分折中,一定错误的是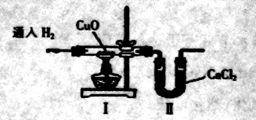
| A.I装置前缺少干燥装置 |
| B.II装置后缺少干燥装置 |
| C. CuO部分被还原成CusO |
| D.通H2前I装置中玻璃管内有水冷凝 |
200°C时,11.6克C02和水蒸气的混合气体与足量的Na2O2充分反应后,固体的质量增加了 3. 6克。从以上信息中,我们得出的下列结论中不正确的是
| A.可以计算出混合气体中CO2和水蒸气的质量 |
| B.可以判断出混合气体的平均摩尔质量 |
| C.可以计算出该反应中转移的电子数 |
| D.可以总结出Na2O2任何反应中既作氧化剂也作还原剂 |
下列关系式正确的是
A.常温下PH=2的甲酸与pH=12的烧碱溶液等体积混合: |
B.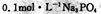 溶液中: 溶液中: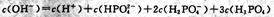 |
C.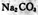 溶液加水稀释后,恢复至原温度,所有离子浓度均减小 溶液加水稀释后,恢复至原温度,所有离子浓度均减小 |
| D. 1L 0.3mol ?L-1NaOH溶液吸收标准状况下4. 48L CO2: |