亚硝酸钠俗称“工业盐”,有很强的毒性,因外观、口感与食盐相似,而常常被误用、误食,为了区分亚硝酸钠与食盐,某研究性小组通过查阅资料后得知:亚硝酸钠具有强氧化性,可与硝酸银溶液反应产生沉淀,亚硝酸是一种弱酸,不稳定,易分解为两种气体,据此设计了如下方案,①分别向盛有两种溶液的试管中加入稀硫酸,如试管中有红棕色气体产生的为亚硝酸钠;②用洁净的玻璃棒分别蘸取两种无色溶液滴在淀粉碘化钾试纸上,出现蓝色的是亚硝酸钠;③向两支盛有硫酸亚铁溶液的试管中分别加入氯化钠和亚硝酸钠,溶液变棕黄色的是亚硝酸钠;④分别向盛有两种溶液的试管中加入硝酸银,有白色沉淀产生的是氯化钠,另一支试管内是亚硝酸钠。其中能够区分亚硝酸钠与食盐的操作及结论正确是( )
| A.①②③④ | B.①②④ |
| C.①②③ | D.①③④ |
已知A物质的分子结构简式如下: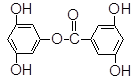 , lmol A与足量的NaOH溶液混合共热,充分反应后最多消耗NaOH的物质的量为()
, lmol A与足量的NaOH溶液混合共热,充分反应后最多消耗NaOH的物质的量为()
| A.5mol | B.6mol | C.7mo1 | D.8mo1 |
A、B两种烃,它们含碳质量分数相同,下列关于A和B的叙述正确的是()
A.A和B一定是同分异构体 B.A和B不可能是同系物
C.A和B最简式一定相同 D.A和B的化学性质相似
某烃结构如下: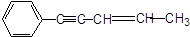 ,有关其结构说法正确的是()
,有关其结构说法正确的是()
| A.所有原子可能在同一平面上 | B.所有原子可能在同一条直线上 |
| C.所有碳原子可能在同一平面上 | D.所有氢原子可能在同一平面上 |
萘环上的碳原子的编号如(I)式,根据系统命名法,(Ⅱ)式可称为2一硝基萘,则化合物(Ⅲ)的名称应是()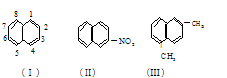
| A.2,6一二甲基萘 | B.1,4一二甲基萘 |
| C.4,7一二甲基萘 | D.1,6一二甲基萘 |
下列物质的沸点按由高到低的顺序排列正确的是()
①CH3(CH2)2CH3 ②CH3(CH2)3CH3 ③(CH3)3CH ④(CH3)2CHCH2CH3
| A.②④①③ | B.④②①③ | C.④③②① | D.②④③① |