下列叙述不正确的是( )
| A.硝酸银溶液通常保存在棕色试剂瓶中,是因为硝酸银见光易分解 |
| B.乙醇的沸点比甲醚( CH3—O—CH3)高,主要原因是乙醇分子间能形成氢键 |
| C.反应AgCl+NaBr══AgBr+NaCl能在水溶液中进行,是因为AgBr比AgCl更难溶于水 |
| D.常温下浓硫酸可贮存于铁制或铝制容器中,说明常温下铁和铝与浓硫酸不反应 |
下列关于实验室制备乙酸乙酯和乙酸丁酯的描述正确的是
| A.均采用水浴加热 | B.制备乙酸丁酯时正丁醇过量 |
| C.均采用边反应边蒸馏的方法 | D.制备乙酸乙酯时乙醇过量 |
为测定镀锌铁皮锌镀层的厚度,将镀锌皮与足量盐酸反应,待产生的气泡明显减少时取出,洗涤,烘干,称重。关于该实验的操作对测定结果的影响判断正确的是
| A.铁皮未及时取出,会导致测定结果偏小 |
| B.铁皮未洗涤干净,会导致测定结果偏大 |
| C.烘干时间过长,会导致测定结果偏小 |
| D.若把盐酸换成硫酸,会导致测定结果偏大 |
下列鉴别方法不可行的是
| A.用水鉴别乙醇、甲苯和溴苯 |
| B.用燃烧法鉴别乙醇、苯和四氯化碳 |
| C.用碳酸钠溶液鉴别乙醇、乙酸和乙酸乙酯 |
| D.用酸性高锰酸钾溶液鉴别苯、环已烯和环已烷 |
下列叙述I和II均正确并且有因果关系的是
| 选项 |
陈述I |
陈述II |
| A |
NH4Cl为强酸弱碱盐 |
用加热法除去NaCl中的NH4Cl |
| B |
Fe3+具有氧化性 |
用KSCN溶液可以鉴别Fe3+ |
| C |
溶解度:CaCO3<Ca(HCO3)2 |
溶解度:Na2CO3<NaHCO3 |
| D |
SiO2可与HF反应 |
氢氟酸不能保存在玻璃瓶中 |
下图所示仪器可用于实验室制备少量无水FeCl3,仪器连接顺序正确的是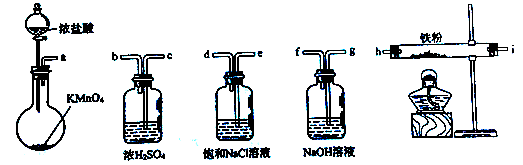
| A.a-b-c-d-e-e-f-g-h | B.a-e-d-c-b-h-i-g |
| C.a-d-e-c-b-h-i-g | D.a-c-b-d-e-h-i-f |