将铁的化合物溶于盐酸,滴加KSCN溶液不发生颜色变化,再加入适量氯水,溶液立即呈红色的是( )
| A.Fe2O3 |
| B.FeCl3 |
| C.Fe2(SO4)3 |
| D.FeO |
下列电离或化学方程式书写正确的是
A.N a3PO4=Na++3PO43- a3PO4=Na++3PO43- |
| B.CaCO3+2HNO3=Ca(NO3)2+H2O+CO2↑ |
C.2KClO3+MnO2  2KCl+MnO2+3O2↑ 2KCl+MnO2+3O2↑ |
| D.C2H5OH= C2H5O- +H+ |
下列反应属于氧化还原反应的是
A.H2+Cl2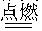 2HCl 2HCl |
B.CaCO3+2HCl=CaCl2+CO2 ↑+H2O |
C.CuSO4+BaCl2=BaSO4 ↓+CuCl2 ↓+CuCl2 |
D.NH4HCO3 NH3↑+CO2↑+H2O NH3↑+CO2↑+H2O |
按照物质的组成和性质进行分类,HNO3应属于
①酸②氧化物③无氧酸④挥发性酸⑤化合物⑥混合物⑦纯净物⑧一元酸
| A.①④⑤⑦⑧ | B.②③④⑤ | C.③④⑤⑦ | D.②⑤⑥⑦⑧ |
用NA表示阿伏加德罗常数的值,下列叙述中正确的是
A.含有NA个氦原子的氦 气在标准状况下的体积约为11.2L 气在标准状况下的体积约为11.2L |
| B.25oC,101kPa,64g SO2中含有的原子数为3NA |
| C.在常温常压下,11.2L Cl2含有的分子数为0.5NA |
| D.标准状况下,11.2L H2O含有的分子数为0.5NA |
下列说法正确的是
| A.摩尔是物质的质量单位 | B.氢气的摩尔质量是2g |
C.1mol H3O+的质量 是19g 是19g |
D.摩尔质量与1mol该物质的质量相等 |