2003年10月15日,我国成功发射“神舟五号”载人飞船,飞船以铝粉与高氯酸铵的混合物为固体燃料,其中高氯酸铵的反应为:2NH4ClO4====N↑+Cl2↑+2O2↑+4H2O。下列有关叙述正确的是( )
| A.该反应属于分解反应、氧化还原反应 |
| B.上述反应瞬间能产生大量高温,高温是推动飞船飞行的主要因素 |
| C.铝粉的作用是点燃时氧化放热引发高氯酸铵反应 |
| D.在反应中NH4ClO4仅起到氧化剂作用 |
丙酸、甲酸乙酯和乙酸甲酯三种有机物共同具有的性质是( )
| A.都能发生加成反应 | B.都能发生水解反应 |
| C.都能跟稀H2SO4反应 | D.都能跟NaOH溶液反应 |
1 mol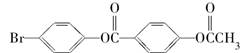 与足量的NaOH溶液充分反应,消耗的NaOH的物质的量最多为( )
与足量的NaOH溶液充分反应,消耗的NaOH的物质的量最多为( )
| A.6 mol | B.5 mol | C.4 mol | D.3 mol |
下列说法中正确的是( )
| A.乙醛分子中的所有原子都在同一平面上 |
| B.凡是能发生银镜反应的有机物都是醛 |
| C.醛类既能被氧化为羧酸,又能被还原为醇 |
| D.完全燃烧等物质的量的乙醛和乙醇,消耗氧气的质量相等 |
第三十届奥运会(夏季)于2012年7月在伦敦如期举行。有一种有机物,因其酷似奥林匹克旗中的五环,科学家称其为奥林匹克烃(结构式如图),下列有关奥林匹克烃的说法不正确的是( )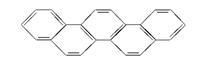
| A.属于芳香烃,是苯的同系物 |
| B.平面型分子,其分子式为C22H14 |
| C.该烃的一氯代物只有七种 |
| D.该烃完全燃烧生成H2O的物质的量小于CO2的物质的量 |
某有机物的结构为下图所示,这种有机物不可能具有的性质是( )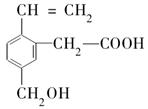
①可以燃烧;②能使酸性KMnO4溶液褪色;③能跟NaOH溶液反应;④能发生酯化反应;⑤能发生加聚反应;⑥能发生水解反应
| A.①④ | B.只有⑥ | C.只有⑤ | D.④⑥ |