下图虚线框中的装置可用来检验浓硫酸与木炭粉在加热条件下反应产生的所有气体产物,填写下列空白。
(1)如下图将装置中①②③三部分仪器的连接顺序变为②①③,则可以检验出的物质
是___________;不能检验出的物质是___________。
(2)如果将仪器的连接顺序变为①③②,则可以检验出的物质是___________;不能检验出的物质是___________。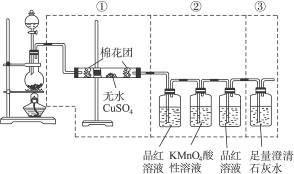
(3)如果将仪器的连接顺序变为②③①,则可以检验出的物质是___________;不能检验出的物质是___________。
(10分)现欲分离乙酸乙酯、乙酸、乙醇的混合物,下图是分离操作步骤流程图。请在图中圆括号内填入适当的试剂,在方括号内填入适当的分离方法,在方框内填入所分离的有关物质的名称:
(1)写出各有关物质的名称:
| A._________________, | B._________________ | C._________________, | D._________________,E._________________。 |
(2)写出加入的试剂:
a._____________,b._____________。
(3)写出有关的操作方法:
①_____________,②_____________,③_____________。
(11分)铅蓄电池是典型的可充型电池,它的正负极隔板是惰性材料,电池总反应式为:
Pb+PbO2+4H++2
 2PbSO4+2H2O
2PbSO4+2H2O
请完成下列问题(不考虑氢、氧的氧化还原):
(1)放电时:正极的电极反应式是__________________;电解液中H2SO4的浓度将变__________________;当外电路通过1 mol电子时,理论上负极板的质量增加_________________g。
(2)在完全放电耗尽PbO2和Pb时,若按下图连接,电解一段时间后,则在A电极上生成_________________、B电极上生成_________________,此时铅蓄电池的正负极的极性将_________________。
下图是测定植物的某一生命活动过程的实验装置。A瓶中NaOH溶液的作用是__________________________________________________________________________,B瓶中的石灰水的作用是___________________________________________,D瓶中出现的现象是___________________________________________。此实验说明植物具有_________性质。
某化学课外小组的同学用Mg等与稀硫酸反应制H2,根据反应进行的情况,同学们得出了反应时间与产生H2的体积关系,并做出了如下图象。请回答:
(1)分析判断,_____________段化学反应速度最快,原因可能是___________________;
FG段化学反应速率较慢的原因可能是____________________________________________。
(2)为了降低该反应的反应速率,你认为可以采取哪些措施_________________(至少说出两种)。
电子工业使用的印刷线路板,是在敷有铜膜的塑料板上以涂料保护所需的线路,然后用FeCl3的溶液与未受保护的铜膜反应以去掉铜,腐蚀后的废液中含有大量的Cu2+。为了回收这一部分Cu2+并制成硫酸铜晶体(CuSO4·5H2O),常用如下步骤:
①向废液中加过量的铁屑,搅拌,静置;②滤出固体物质;③将滤出的固体物质加热煅烧;④把煅烧后的物质放在硫酸中溶解;⑤调节溶液的pH在3.4—4之间,使Fe(OH)3沉淀完全,过滤;⑥浓缩滤液,析出晶体;⑦将过滤得到的晶体溶解,再结晶。
(1)上述③步操作所得煅烧产物成分是_______________。
A.CuO B.CuO和FeO C.CuO和Fe2O3D.CuO和Fe3O4
(2)上述第⑤步操作中,调节溶液的pH宜加入的物质是_______________。
A.氧化铜粉末 B.NaOH溶液 C.稀氨水 D.Na2CO3
(3)上述第⑥步操作中,用浓缩滤液而不用蒸干溶液的主要原因是_______________。
A.蒸干所得到的物质可能含有无水硫酸铜
B.温度升高CuSO4溶解度增大
C.温度升高Cu2+被还原为Cu
D.温度升高CuSO4分解